Konferencja Terapeutyczna Choroby Huntingtona 2020 – Dzień 1.
HDBuzz zdaje raport z dorocznej Konferencji Terapeutycznej Choroby Huntingtona w Palm Springs


Nasze nowe autorki, Rachel Harding i Sarah Hernandez, zdają raport z Konferencji Terapeutycznej Choroby Huntingtona – największego corocznego zgromadzenia badaczy pracujących nad HD.
Wtorkowy poranek – genotyp i fenotyp choroby Huntingtona
Witamy ze słonecznego Palm Springs! Jest to bardzo ekscytujące, być tutaj na 15-stej dorocznej Konferencji Terapeutycznej HD. W tym roku, prócz Eda i Jeffa, dołączyły do nas nowe autorki HDBuzz – Dr. Rachel Harding oraz Dr. Sarah Hernandez. Joel Stanton scala w codzienne posty nasze wpisy umieszczane na bieżąco na Twitterze.

Sesja 1. zatytułowana jest „Genotyp i Fenotyp”, a wystąpienia dotyczą zagadnienia, jak mutacja powodująca HD (genotyp) wpływa na wystąpienie objawów choroby (fenotyp).
Najpierw występuje Dr Seth Ament, odnosząc się do swojej pracy laboratoryjnej, której celem jest mapowanie – opis pierwszych zmian, które zachodzą w komórkach mózgu myszy z obecną mutacją HD. Komórki naszego organizmu, w tym również mózgu, posiadają DNA, w którym znajduje się zapis ponad 20 tsięcy genów. To, które geny są aktywne, a które nie, determinuje funkcję komórki. Laboratorium Amenta zajmuje się badaniem, w jaki sposób geny ulegają ekspresji (czyli są aktywowane) i dąży do zrozumienia, jakie konkretne czynniki decydują o ekspresji danych genów w komórce dotkniętej HD – w nadziei na możliwość naprawienia tego procesu.
Po pierwsze Ament opisuje swoją pracę nad określaniem lokalizacji, w której białko huntingtyna, produkt genu HD, przyczepia się do DNA. Najbardziej oczywisty sposób, w jaki huntigtyna mogłaby wpływać na to, które geny są włączane, a które wyłączane, to przyłączanie się bezpośrednio do DNA. Wykazano, że huntingtyna dołącza się do innych części genomu u myszy z HD niż u myszy zdrowych. Wynika z tego, że huntingtyna może wywierać wpływ bezpośrednio na DNA, a poznanie tego procesu jest ważne dla zrozumienia choroby Huntingtona.
U myszy z mutacją huntigntyna przyczepia się do DNA w miejscach, gdzie geny są odczytywane i wykorzystywane – wiele się tam dzieje. Sugeruje to, że zmutowana huntingtyna może doprowadzać do unikatowych procesów w miejscach, w których geny są aktywnie wykorzystywane. Czy ta zmiana obszarów, w których huntingtyna przylega do DNA, może pomóc w wytłumaczeniu, skąd zamieszanie w komórkach ze zmutowanym białkiem?
Faktem jest, że obszary, w których huntingtyna przylega do DNA zmutowanych myszy, zawierają właśnie te geny, które zmieniają się w komórkach dotkniętych HD, co sugeruje, że może to być prawda. Zespół Amenta dostrzegł zadziwiający związek – są w stanie przewidzieć, czy DNA z danego regionu będzie aktywne czy nieaktywne, na podstawie tego, jak dobrze przyczepia się do niego huntingtyna.
Następnie Ament opisuje dążenia jego laboratorium do określenia, które geny ulegają zmianom w mózgach dotkniętych HD. Niesamowite nowe technologie umożliwiają naukowcom mapowanie genów w poszczególnych komórkach. Laboratorium Amenta wykorzystuje te techniki w ramach NIH’s BRAIN Initiative (Inicjatywy BRAIN Narodowych Instytutów Zdrowia). Celem jest zbadanie zmian zachodzących w 13 tysiącach komórek mózgów myszy z HD. W mózgu istnieją różne rodzaje komórek, a podejście Amenta sprawia, że możliwe jest opisywanie zmian w każdym typie z osobna. Daje to znacznie lepszy obraz niż w sytuacji, w której komórki byłyby analizowane zbiorowo. Przy indywidualnym podejściu do każdego typu komórek, wyniki są lepszą wskazówką i pomagają lepiej zrozumieć, co dzieje się w poszczególnych komórkach – co może z kolei pomóc w określeniu, jak leczyć każdy typ.
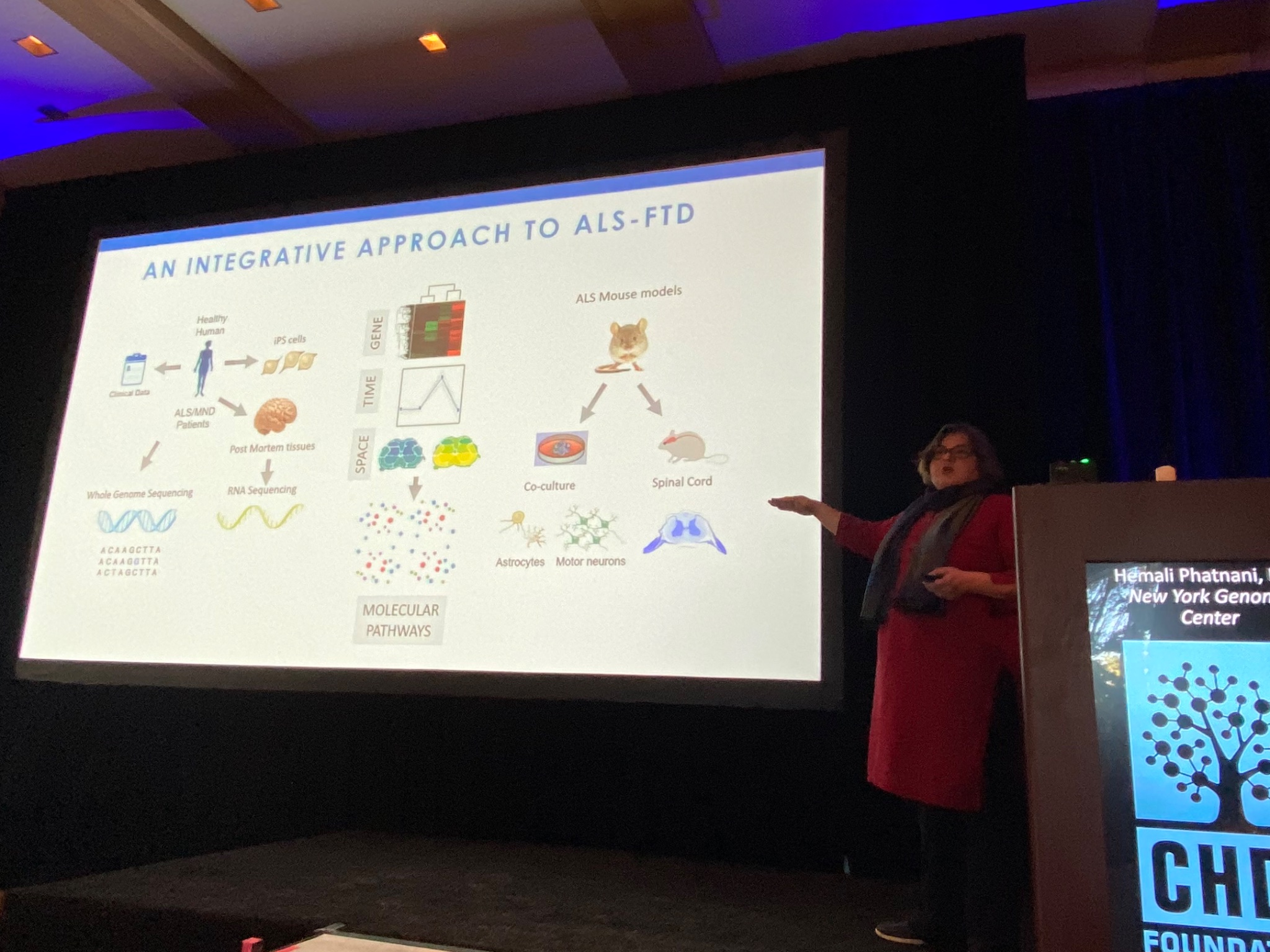
W następnej kolejności występuje Hemali Phatnani z New York Genome Center (Centrum Genomu w Nowym Jorku), która opisuje swoje badanie dotyczące zmian zachodzących w mózgu i rdzeniu kręgowym pacjentów z ALS (czyli stwardnieniem zanikowym bocznym lub inaczej chorobą Lou Gehriga) oraz z otępieniem czołowo-skroniowym (FTD). Phatnani pracuje z dużym zespołem klinik ALS, by zyskać dostęp do rzadkich próbek przekazanych przez pacjentów z ALS. Są one analizowane, a dane są natychmiastowo udostępniane badaczom z całego świata – jest to świetny model otwartej współpracy naukowej! Tak jak HD, ALS jest złożoną chorobą; różne typy komórek mózgu ulegaja odmiennym zmianom w miarę postępu choroby. Zespół Phatnani pomógł rozwinąć nowe metody mapowania zmian w komórkach mózgów osób z ALS. Te techniki pozwalają na zbadanie konkretnych procesów, a otrzymane dane są dostępne dla wszystkich badaczy (bądź innych ciekawych tego osób) na als-st.nygenome.org.
Następne wystąpienie prowadzi Sumanjit Jayadev z Medical Center Uniwersytetu Waszyngtońskiego. Interesuje się konkretnym typem komórek mózgu – mikroglejem. Odgrywa on rolę w postępie choroby Huntingtona, a usuwanie mikrogleju u myszy z HD jest pomocne w opanowaniu objawów. Naukowcy od jakiegoś czasu wiedzą, że choroba Huntingtona wywołuje reakcję zapalną; Jadayev interesuje się tym, jakie inne – prócz neuronów – komórki mózgu biorą udział w procesie zapalnym. Geny związane z zapaleniem są również czynnikami ryzyka choroby Alzheimera (AD). Jayadev skupia się na tym, by ustalić, w których komórkach geny te są aktywowane, by określić ryzyko choroby – z zastosowaniem świetnej techniki dostarczających dane z poziomu pojedynczych komórek. Badanie zmian właśnie w pojedynczych komórkach umożliwiło naukowcom zidentyfikowanie podtypów mikrogleju obecnych wyłącznie w AD. Jayadev pracuje nad tym projektem z ekspertami z Sage Bionetworks, zaangażowanymi w otwartą naukę i otwarte współdzielenie danych w badaniach biomedycznych. Z wykorzystaniem wszystkich tych danych, mogą następnie monitorować progresję choroby Alzheimera poprzez obserwacje, które geny są „włączane”, kiedy i gdzie. Dzięki temu możliwe jest wyodrębnienie grup pacjentów z AD, co pomaga lekarzom klinicystom oraz badaczom zrozumieć, jak przebiega progresja choroby. Jeśli to samo podejście można zastosować w przypadku choroby Huntingtona, być może w przyszłości, znając wiek pacjenta oraz liczbę powtórzeń CAG, lekarze będą mogli podejmować uzasadnione decyzje co do leczenia konkretnej osoby.
Kolejno występuje William Yang, badacz HD z UCLA. Jego laboratorium generuje bardzo wiele danych z różnych modeli mysich z HD; dane pochodzą z obserwacji, jak zachodzi „włączanie” poszczególnych genów oraz które białka są obecne w danych typach komórek, a następnie informacje te są zbierane celem porównania myszy z HD do grup kontrolnych (bez HD). W tych dużych bazach danych, naukowcy mogą poszukiwać schematów i korelacji, które mogłyby wskazywać na to, jakie geny współdziałają u myszy z HD. Schematy te mogą być zmapowane i opisane za pomocą metod obliczeniowych, co ułatwia zrozumienie, jaki jest udział różnych typów komórek mózgu w obserwowanych zmianach ekspresji genów.
W swoim wystąpieniu, Yang mówi o przeprowadzonej analizie z udziałem myszy bez HD jako grupy kontrolnej, w której jego zespół dzięki swojej technice mógł zidentyfikować ważne funkcje oraz określić typ komórek, który te funkcje przeprowadza. Gdy dane z mysich modeli z HD są nanoszone na mapę, okazuje się, że geny odpowiedzialne za regulację cyklu snu i czuwania oraz geny odpowiedzialne za naprawę DNA uległy zmianie – co potwierdziło wcześniej raportowane odkrycia. Mapa może być również wykorzystywana do testowania wielu nowych teorii, które badacze stawiają na temat HD – bardzo potrzebne narzędzie!
Wtorkowe popołudnie – niestabilność somatyczna.
Tematem przewodnim sesji popołudniowej jest proces niestabilności somatycznej. Mówiąc prościej, niestabilność somatyczna występuje, gdy długie sekwencje DNA składające się z licznych powtórzeń, stają się niestabilne w komórkach określonego typu.
Jako pierwszy tego popołudnia występuje Darren Monckton z Uniwersytetu w Glasgow. Zajmuje się badaniem, jak niestabilność somatyczna może napędzać chorobę Huntingtona oraz w jaki sposób obrać tę niestabilność za punkt uchwytu dla nowych leków na HD. Od jakiegoś czasu wiadomo, że długosć fragmentów złożonych z powtórzeń CAG może różnić się w obrębie tkanki – jedne komórki mogą mieć fragmenty dłuższe niż inne. Jest to podobne zjawisko do tego, które obserwujemy w innych chorobach wynikających z ekspansji sekwencji nukleotydów, np. w dystrofii miotonicznej – zmienność długości fragmentów składających się z powtórzeń CAG zwiększa się wraz z wiekiem pacjentów, co sugeruje większą niestabilność. Zatem im więcej jest powtórzeń CAG, tym większa zmienność długości fragmentów u pacjenta i większa niestabilność. Warto wspomnieć, że ogólnie liczba powtórzeń CAG nie zmienia się z wiekiem, a tylko w niektórych komórkach może czasem dojść do zwiększenia długości.
Kodon CAG koduje aminokwas glutaminę, stąd czasem nazywa się chorobę Huntingtona chorobą poliglutaminową. Jednak glutamina może być również kodowana jako CAA, dlatego pomimo różnicy w zapisie DNA, utworzone na jego podstawie białko będzie zawierać to samo, jeśli zamiast CAA w zapisie pojawi się CAG. Dzieje się to na przykład w genie HD, gdzie dodatkowo długi ciąg powtórzeń CAG staje się jeszcze dłuższy w niektórych typach komórek. Jest na ten temat bardziej szczegółowy post tutaj.
Niedawne interesujące odkrycie wykazało, że obecność w niektórych miejscach kodonu CAA zamiast CAG jest korzystna dla zachowania stabilności długości fragmentów powtórzeń. Nasuwa się kolejne ciekawe pytanie, co napędza zmiany doprowadzające do niestabilności somatycznej? Dowody wskazują na związek z procesami naprawy DNA, co ostatnio jest gorącym tematem w badaniach nad HD.
Dzięki identyfikacji konkretnych czynników (genetycznych) zwiększających niestabilność, możliwe byłoby uzyskanie rezultatów terapeutycznych. Badacze pracują obecnie nad tym, by określić, który czynnik jest najistotniejszy w wywoływaniu niestabilności somatycznej oraz by znaleźć takie czynniki, które mogłyby stanowić punkty uchwytu dla nowego leku bądź terapii. Obecnie naukowcy ustalają, jak długość oraz niestabilność długości sekwencji powtórzeń CAG zmieniają się w czasie u konkretnych pacjentów, wszystko dzięki tym z nich, którzy zdecydowali się przekazać próbki oraz dane do programu EnrolHD.
Gdybyśmy mogli śledzić progresję choroby Huntingtona za pomocą pomiarów niestabilności poprzez prosty test z krwi, mogłoby to być mniej inwazyjnym sposobem na monitorowanie pacjentów przez lekarzy i podstawą do dobrania najbardziej odpowiedniego leczenia.
W następnej kolejności występuje Karen Usdin z NIH, która zajmuje się poszukiwaniem niestabilności somatycznej w modelach mysich z inną chorobą dotykającą układu nerwowego, która nazywa się zespół łamliwego chromosomu X. Podobnie jak HD, zespół łamliwego chromosomu X jest chorobą wywoływaną przez ekspansję powtórzeń nukleotydowych, jednak zamiast powtórzeń CAG, występują powtórzenia CGG. Wiele możemy się dowiedzieć na podstawie doniesień o innych chorobach wynikających z ekspansji powtórzeń, ponieważ jak sądzą naukowcy, jest wiele podobieństw między tymi chorobami i czynnikami, które je wzmagają. Podobnie jak w HD, powtórzenia CGG w przebiegu zespołu łamliwego chromosomu X, dotknięte są niestabilnością somatyczną i mają na to wpływ geny związane z naprawą DNA. Usdin ustaliła, że, przynajmniej u myszy z zespołem łamliwego chromosomu X, zmiana poziomów aktywności genów odpowiedzialnych za naprawę DNA zapobiega ekspansji powtórzeń CGG oraz usuwa część powtórzeń! Wspaniale było posłuchać naukowców spoza środowiska HD, którzy dzielą się interesującymi pomysłami i wiedzą, co może pchnąć badania w zakresie HD naprzód!
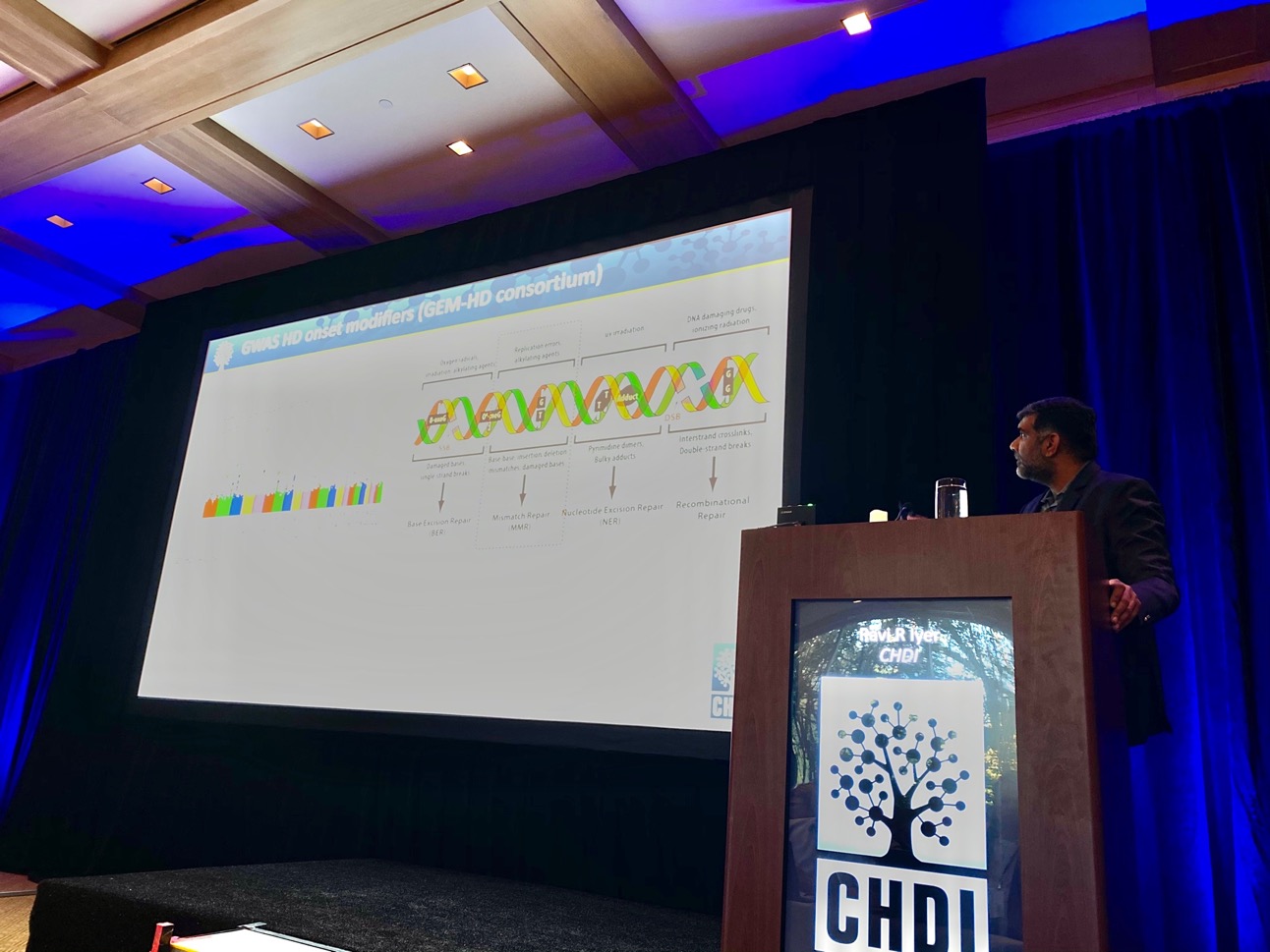
Ostatnie wystąpienie w tej sesji prowadzi Ravi Iyer z CHDI – omawia jeden z programów odkrywania nowych leków, w który naukowcy są zaangażowani. Jednym z celów tego programu jest identyfikacja małych cząsteczek, które stabilizowałyby ekspansję powtórzeń CAG w przebiegu HD. CHDI pracuje z wieloma różnymi firmami, by odkryć te małe cząsteczki z wykorzystaniem wielu różnych technik – prace mogą postępować szybciej dzięki kolaboracji w ramach projektu.
Jednym ze sposobów identyfikacji wspomnianych cząsteczek, który mógłby zadziałać, jest przyjrzenie się szczegółowym modelom struktury cząstek, które mają stać się celem – przykładem są białka uczestniczące w naprawie DNA. Najlepsze w tym projekcie jest to, że gdyby okazało się, że te małe cząsteczki są efektywne w leczeniu HD, mogłyby być przyjmowane jako leki. Perspektywa leczenia za pomocą drobnych cząstek jest bardzo obiecująca, lecz naukowcy muszą zachować szczególną ostrożność w obawie przed nieoczekiwanymi działaniami ubocznymi.
Tworzenie małych cząsteczek, które mogłyby być lekami na HD, jest ekscytującym projektem, jednak czeka jeszcze długa droga, nim będzie wiadomo, czy zakończy się on sukcesem. Duży zespół naukowców prowadzony przez CHDI pracuje nad tym ciężko i z ekscytacją będziemy oczekiwać nowych informacji przy okazji kolejnych spotkań.
Następnie przemawia Brian Bettencourt z Triplet Therapeutics, jednej z wielu firm, która również pracuje w tym obszarze; opowie więcej o obieraniu niestabilności somatycznej za cel terapeutyczny. Jednym z ich celów jest zatrzymanie niestabilności ekspansji powtórzeń CAG oraz opóźnienie rozwinięcia się HD – miejmy nadzieję, że aż do wieku tak późnego, że nie byłaby to nawet realistyczna długość życia! Jest to tak obiecujący obszar badań, że naukowcy musieli ustalić priorytety – nad którymi cząsteczkami będą pracować najpierw. To pozwala im na efektywną pracę nad ich celem, jakim jest jak najszybsze dostarczenie obiecujących rozwiązań terapeutycznych dla HD. Po określeniu priorytetów pod wdględem bezpieczeństwa i niskiego ryzyka, zespół Bettencourt’a otrzymał cząstki, które celują w 8 różnych genów. Jest to relatywnie duża liczba celów, ale również wystarczająco mała, by można było przeprowadzić proces relatywnie szybko. To badanie także jest częścią większej współpracy, gdyż Bettencourt współpracuje z Jeffem Carrollem z HDBuzz nad wyznaczaniem różnych potencjalnych celów terapeutycznych. Jego zespół w przyszłym roku będzie zdawać raport z tych badań, więc bądźcie na bieżąco, by przekonać się, czy obieranie za cel niestabilności somatycznej sprawdzi się w terapii HD.
Ostatnim mówcą dnia jest sam Jeff Carroll z HDBuzz, który podsumowuje sesję dotyczącą niestabilności somatycznej. Jedna z rzeczy, którymi Carroll jest zainteresowany, to zrozumienie efektu, jaki daje obniżenie poziomu białka huntingtyny w tkance innej niż tkanka mózgu, np. w wątrobie. Co ciekawe, obniżenie poziomu huntingtyny obniża poziom niestabilności somatycznej w konkretnych typach komórek, ale nie we wszystkich. Laboratorium Carrolla chciało poznać szczegóły tego odkrycia, dlatego współpracują z Sarah Tabrizi, by mieć wgląd w ludzkie neurony. Obniżanie poziomu huntingtyny u myszy bez HD (ale z ataksją, która też jest wywoływana przez powtórzenia CAG) pokazuje, że tam również zmniejsza się niestabilność somatyczna, co sugeruje, że huntingtyna ogólnie odrywa rolę w rozwoju niestabilności. Jeśli huntingtyna wpływa na stabilność genomu i na to, w jakim stanie utrzymywane jest DNA, laboratorium Carrolla jest na drodze do odkrycia, jak może się to dziać i jaki ma to wpływ na pacjentów z HD. Jest to zupełnie nowa obserwacja, więc jest dla badaczy naprawdę ekscytująca!
I to wszystko na Dzień 1! Nie przegapcie relacji z kolejnych dni, 2. i 3. oraz śledźcie konwersację na Twitterze.
Więcej informacji o naszej polityce ujawniania informacji znajdziesz w naszym FAQ…