Uspokojenie systemu immunologicznego pomaga myszom z chorobą Huntingtona
Aktywator CB2 poprawia żywotność i objawy myszy z chorobą Huntingtona uspokajając ich układ odpornościowy
 Napisany przez Professor Ed Wild styczeń 28, 2013 Zredagowany przez Dr Jeff Carroll Przetłumaczony przez Arkadiusz Szatkowski Po raz pierwszy opublikowany grudzień 22, 2012
Napisany przez Professor Ed Wild styczeń 28, 2013 Zredagowany przez Dr Jeff Carroll Przetłumaczony przez Arkadiusz Szatkowski Po raz pierwszy opublikowany grudzień 22, 2012
Uważa się, że w chorobie Huntingtona układ odpornościowy nie zachowuje się normalnie. Wykazano, że lek aktywujący receptory CB2 na komórkach odpornościowych poprawia objawy i długość życia myszy HD – czyniąc z układu immunologicznego cel nowych terapii na HD.
Układ odpornościowy w HD
Choroba Huntingtona jest nazywana chorobą neurodegeneracyjną, ponieważ większość objawów powoduje nieprawidłowe działanie i obumieranie neuronów. Ale zmutowana huntingtyna powodująca HD powstaje we wszystkich komórkach ciała, dlatego w ostatnich latach w poszukiwaniu kuracji na HD badacze wyszli poza mózg.
Odkrycie, będące skutkiem tego podejścia mówi, że system immunologiczny - nasza tarcza przed infekcjami - u chorych na HD może działać nieco inaczej.
Przeciętnie, u osób z mutacją choroby Huntingtona poziom cytokin (cząsteczek sygnałowych układu odpornościowego, przyp. tłum.) jest wyższy niż normalnie, nawet jeszcze przed pojawieniem się objawów. Również białe krwinki pacjentów HD są nadpobudliwe - hodowane w laboratorium i potraktowane bakteriami - uwalniają więcej cytokin niż normalnie.
Zależności pomiędzy genem HD, zachowaniem układu odpornościowego i mózgu są nadal badane. Ale już pojawiły się oznaki, że sztuczna zmiana zachowania układu odpornościowego może być jednym ze sposobów walki z HD.
W zeszłym roku grupa naukowców pod kierownictwem dr Pawła Muchowskiego w Gladstone Institute of Neurological Disease w Kalifornii wykazała, że zmiana chemicznych zachowań białych krwinek, przy pomocy leku o nazwie JM6, wydłużyła życie myszy HD. Na początku tego roku, zespół Muchowskiego poinformował, że przeszczepienie szpiku ‘normalnych’ myszy myszom z HD było nieco korzystne.
Badanie układu odpornościowego, w celu zrozumienia HD i pod kątem ewentualnej terapii, jest teraz gorącym tematem. Nowym artykułem w czasopiśmie Journal of Neuroscience zespół Muchowskiego wrócił do tematu - tym razem z niezwykłym studium równoważenia aktywności ‘receptorów CB2’ układu odpornościowego.
Receptory CB2?
Receptor to cząsteczka, która wystaje z komórki i oczekuje na chemiczny sygnał. Kiedy taki się pojawia, receptor wyzwala serię zdarzeń chemicznych wewnątrz komórki, prowadzących do zmiany zachowania komórki.
Każdy receptor może ‘przechwycić’ określony sygnał chemiczny i każdy wywołuje inną serię zdarzeń w komórce. Dzięki temu każda komórka ciała może odpowiednio reagować na różne sygnały.
Receptory CB2 są częścią rodziny receptorów kannabinoidowych. Nazywa się je tak, bo mogą one być wywołane przez substancje chemiczne zawarte w konopiach indyjskich. Ale - żeby było jasne - to nie jest badanie marihuany!
Interesującą cechą receptorów CB2 jest to, że występują przeważnie w komórkach układu immunologicznego. Aktywacja receptorów CB2 ‘uspokaja’ komórki odpornościowe, które w efekcie produkują mniej własnych molekuł sygnałowych - cytokin, o których wspominaliśmy wcześniej.
Wiedząc to i wiedząc, że w chorobie Huntingtona układ immunologiczny jest zbyt aktywny, aktywacja receptorów CB2 wydaje się być pożyteczną. Z drugiej strony - wyłączenie w HD receptorów CB2 może być szkodliwe. Zespół Muchowskiego przyjrzał się obydwu możliwościom, zaczynając od tej drugiej.
Wybijanie genu CB2
Zespół rozpoczął prace od myszy z chorobą Huntingtona zwanych myszami BACHD, które produkują zmutowane ludzkie białko huntingtyny i wykazują objawy podobne do HD. Objawy u myszy BACHD pojawiają się około szóstego miesiąca życia i postępują powoli.
Dzięki inżynierii genetycznej, naukowcy stworzyli myszy BACHD pozbawione genu odpowiedzialnego za receptor CB2. Usunięcie genu w ten sposób nazywa się genetycznym ‘wybiciem’.
„Gdy po trzynastu tygodniach przerwano próby, 30% nieleczonych myszy zmarło. Z myszy leczonych GW nie zmarła żadna. ”
U myszy BACHD pozbawionych receptorów CB2 objawy pojawiły się znacznie szybciej niż u zwykłych myszy BACHD - w około trzecim miesiącu, nie w szóstym.
Aby sprawdzić, czy wcześniejsze wystąpienie objawów nie było prostym następstwem tego, że brak CB2 jest dla mózgu zły, zespół Muchowskiego przyjrzał się trzeciej partii myszy. Były pozbawione CB2, ale nie produkowały zmutowanej huntingtyny. Te myszy wydawały się zwyczajne. Dopiero oba zaburzenia genetyczne razem - produkcja zmutowanej huntingtyny oraz brak CB2 - powodowały, że objawy u myszy postępowały bardzo szybko.
Nie chodziło tylko o postępujące objawy myszy. Naukowcy przyjrzeli się poziomowi białka zwanego synaptofizyną w mózgach myszy. Synaptofizyna jest istotna dla połączeń między neuronami. W mózgach myszy BACHD pozbawionych receptorów CB2 było jej znacznie mniej.
Aktywacja CB2 lekiem GW
Mając wyniki wybijania CB2 sugerujące, że receptory CB2 pomagają w jakiś sposób utrzymać w ryzach objawy choroby Huntingtona, zespół Muchowskiego przeszedł do następnego etapu - próby zwiększenia aktywności receptorów CB2. Aby to osiągnąć wykorzystano lek aktywujący CB2 o nazwie GW405833, w skrócie GW.
Aby sprawdzić, czy aktywacja receptorów CB2 lekiem GW jest korzystna, naukowcy wykorzystali mysi model choroby Huntingtona - myszy R6/2. Myszy te rozwijają objawy w bardzo młodym wieku i szybko chorują.
GW wstrzykiwano myszom R6/2 regularnie, krótko po pojawieniu się objawów, począwszy od czwartego tygodnia życia. Objawy ruchowe myszy badano mierząc zdolność zachowania równowagi. Myszy leczone GW miały się lepiej niż myszy nieleczone - utrzymywały równowagę na walcu obrotowym prawie dwa razy dłużej.
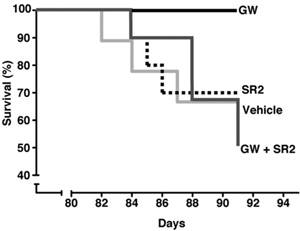
Myszy R6/2 umierają zazwyczaj po około pięciu miesiącach, ale leczenie GW dało całkiem spektakularne rezultaty. Gdy po trzynastu tygodniach przerwano próby, 30% nieleczonych myszy zmarło. Z myszy leczonych GW nie zmarła żadna. Oczywiście nie wiemy, jak długo myszy żyły po zakończeniu badania, ale jak by na to nie patrzeć - to zastanawiające wyniki.
Następnie zespół Muchowskiego zmierzył poziom synaptofizyny w mózgu. Przypomnijmy, że był niższy u myszy z wybitym genem odpowiedzialnym za receptor CB2. U myszy leczonych GW poziom synaptofizyny był wyższy, co sugeruje, że jednym z korzystnych skutków GW jest poprawa połączeń między neuronami.
Mając tak dobre wyniki, naukowcy powtórzyli próbę, tym razem rozpoczęli leczenia miesiąc później, w ósmym tygodniu życia gryzoni. Do tego czasu myszy były już bardzo chore. Ale lek nadal działał korzystnie na problemy ruchowe i połączenia mózgowe.
Krew czy mózg?
Receptory CB2 występują głównie na komórkach odpornościowych, które z kolei przeważnie znajdują się we krwi, szpiku kostnym i śledzionie. Mózg ma własne komórki odpornościowe zwane mikroglejem. Dlatego należało odpowiedzieć na pytanie, które komórki faktycznie leczy GW. Czy poprawia objawy działając na mikroglej w mózgu czy też białe krwinki w organizmie?
Aby się tego dowiedzieć zespół Muchowskiego wykonał sprytny trik. Niektórym myszom R6/2 podawano dwa leki. Pierwszy to GW, drugi to ‘antagonista’ CB2 nazywany SR2. Antagonista to lek, który blokuje aktywność receptora. Zatem SR2 i GW znoszą wzajemnie swoje działanie, i dają taki efekt, jakby nie był podawany żaden lek.
Nie wygląda to zbyt mądrze, dopóki nie uświadomimy sobie, że leki docierają do różnych miejsc w organizmie. GW rozchodzi się wszędzie - we krwi, organach i mózgu. Ale SR2 nie dociera do mózgu - pozostaje we krwi i narządach. Zatem, ponieważ SR2 neutralizuje efekty GW w organizmie, u myszy leczonych obydwoma lekami efekty działania GW będą widoczne wyłącznie w mózgu.

Gdyby GW działał w mózgu można by się spodziewać poprawy u podwójnie leczonych zwierząt - ale tak się nie stało. Myszy zachorowały i umarły jak inne, nieleczone myszy. To sugeruje, że korzyści leku GW płyną z jego działania na komórki układu immunologicznego poza mózgiem.
Coś podobnego obserwowano przy innym leku Muchowskiego - JM6. Wyniki obydwu leków wskazują, że zmiana zachowania układu odpornościowego organizmu może mieć korzystny wpływ na mózg, co otwiera wiele nowych linii ataku w walce z chorobą Huntingtona.
O krok dalej
Jak działanie GW na komórki odpornościowe może korzystnie wpływać na mózg? Jedną z możliwości jest oddziaływanie na cytokiny - wspomniane wcześniej chemiczne cząsteczki sygnałowe układu odpornościowego. Przypomnijmy, że poziom tych cytokin w próbkach krwi pacjentów z chorobą Huntingtona był podwyższony, zwłaszcza jednej o nazwie IL-6.
Kiedy zespół Muchowskiego zmierzył stężenie IL-6 u myszy leczonych GW okazało się, że były one obniżone - faktycznie, GW ‘uspokoił’ zbyt aktywny układ odpornościowy. Naukowcy przeprowadzili dalsze badania IL-6.
Tym razem wstrzyknęli myszom R6/2 białka przeciwciał, które przyklejają się do IL-6 i nakazują ciału pozbycie się IL-6. Myszy leczone przeciwciałem redukującym IL-6 miały lepszą kontrolę ruchu niż nieleczone. Efekt nie był tak spektakularny, jak ten obserwowany z GW, ale był, co sugeruje, że obniżenie IL-6 może być jednym z efektów korzystnego oddziaływania GW na mózg.
Reasumując
To badanie, lata pracy naukowców, daje nam dużo do myślenia.
Wiedzieliśmy już wcześniej, że w HD układ odpornościowy zachowuje się nieco inaczej, ale było mniej jasne, czy jego bezpośrednie leczenie to dobry pomysł.
Badanie Muchowskiego stanowi silny dowód na to, że receptory CB2 są ważnym ogniwem pomiędzy układem odpornościowym organizmu i chorobą Huntingtona w mózgu.
Lek GW spektakularnie pomógł bardzo chorym myszom R6/2, ale nigdy nie był testowany na ludziach, więc potrzebnych będzie wiele testów bezpieczeństwa by upewnić się, że nie jest szkodliwy. Leki, które aktywują receptory CB w niektórych krajach są licencjonowane (np. Sativex na objawy stwardnienia rozsianego), ale na rynku nie ma aktywatorów CB2.
Warto także pamiętać, że inne leki, które poprawiały stan myszy R6/2, do tej pory nie zadziałały na ludziach, bo żadne zwierzę nie jest idealnym modelem choroby Huntingtona.
Interesującym elementem tych badań są umiarkowane korzyści przeciwciała IL-6. Co ciekawe, taki lek jest już dopuszczony do stosowania u ludzi w zapaleniu stawów - nazywa się tocilizumab (lub Actemra). Badanie tego leku na pacjentach z chorobą Huntingtona jest możliwe i prawdopodobnie ma większą szansę na realizację niż badanie leku GW.
Wreszcie - bo wiemy, że wciąż zastanawiasz - to badanie w żaden sposób nie rozstrzyga, czy marihuana jest korzystna dla pacjentów z chorobą Huntingtona. Choć marihuana zawiera cząsteczki aktywujące CB2, zawiera również setki innych substancji chemicznych, z których wiele ma inne skutki biologiczne, które nie zostały sprawdzone w HD. Chociaż wiemy, że marihuana jest popularna w HD i nie tylko, to na podstawie niniejszego opracowania nie możemy przybić jej naukowej pieczęci aprobaty.