
Skupiając się na fibrylach; naukowcy dają nam wgląd w skupiska białka huntingtyny
Naukowcy użyli potężnych mikroskopów, aby przyjrzeć się lepkim fragmentom białka choroby Huntingtona, rzucając światło na te struktury, które uważa się za czynnik napędzający chorobę

Grupa naukowców z EPFL w Lozannie w Szwajcarii opublikowała artykuł w Journal of the American Chemical Society, w którym opisuje skupiska utworzone z fragmentu białka huntingtyny. Powszechnie używanym określeniem na te skupiska są „agregaty”. Dzięki bardzo zaawansowanym mikroskopom zespół był w stanie powiększyć i przyjrzeć się szczegółom struktur 3D tych próbek. Uważa się, że gromadzenie się agregatów białka huntingtyny jest ważną cechą choroby Huntingtona (HD), przyczyniającą się do postępu choroby. Ale do niedawna bardzo mało wiedzieliśmy o tym, jak one wyglądają. Dzięki tym ekscytującym nowym spojrzeniom na agregaty pod mikroskopem, naukowcy mają nadzieję zbudować narzędzia do wizualizacji ich w mózgach osób z HD, a nawet wysyłać szkodliwe agregaty do kosza na śmieci w komórkach mózgowych.
Agregaty, amyloidy i włókna – co to wszystko oznacza?
Wiele chorób dotykających mózg, w tym choroby neurodegeneracyjne takie jak Parkinson, Alzheimer i Huntington, charakteryzują się nagromadzeniem skupisk cząsteczek białkowych w komórkach mózgowych. W HD to mały i lepki fragment samego białka huntingtyny tworzy te skupiska, które naukowcy często nazywają agregatami huntingtyny.

„Agregat” to wyszukane słowo określające sytuację, w której wiele kopii tej samej cząsteczki białka łączy się ze sobą, tworząc znacznie większe struktury trójwymiarowe. Czasami agregaty te są pomieszanym bałaganem wielu cząsteczek białka. Ale innym razem cząsteczki są znacznie bardziej zorganizowane i tworzą powtarzalne struktury. Niektóre z tych bardziej zorganizowanych struktur wyglądają jak włókna i są nazywane amyloidami lub fibrylami.
Możesz wyobrazić sobie te różne organizacje cząsteczek białka jak wieżę z klocków Jenga. Każdy klocek reprezentuje pojedynczą cząsteczkę białka. Gdy klocki są starannie ułożone w wieżę, przypomina to trochę amyloidy białkowe lub fibryle. Ale gdy klocki w końcu spadną tworząc nieporządny stos, jest to bardziej podobne do tego, jak wyobrażamy sobie, że może wyglądać niezorganizowany agregat białkowy.
Naukowcy generalnie (i irytująco) uwielbiają żargon, więc zobaczysz, że często używają wszystkich tych słów zamiennie. Ale na potrzeby tego artykułu skupimy się na fibrylach huntingtyny; zorganizowanych trójwymiarowych włóknach składających się z wielu, wielu kopii małego i lepkiego fragmentu białka huntingtyny.
O myszach i ludziach… i bakteriach
Agregacja białka huntingtyny jest od dawna udokumentowaną cechą choroby Huntingtona. W mózgach osób, które zmarły z powodu HD, możemy użyć barwników i innych sprytnych znaczników chemicznych, aby zobaczyć te agregaty pod mikroskopem w różnych typach komórek nerwowych. W modelach zwierzęcych HD, które są genetycznie zmodyfikowane do wytwarzania małego lepkiego fragmentu białka huntingtyny, naukowcy wykazali, że te agregaty gromadzą się z czasem. W wielu modelach zwierzęcych HD poziom agregatów w różnych częściach mózgu jest związany z nasileniem objawów podobnych do HD.
Bakterie są modyfikowane genetycznie przez naukowców, aby stały się fabrykami białka huntingtyny, produkując wiele kopii tej cząsteczki
Jednym z problemów z obserwacją agregatów w mózgu jest to, że w komórkach, w których znajdujemy agregaty, jest wiele innych cząsteczek, więc generalnie musimy używać specjalnych barwników, które przyczepiają się do agregatów, aby je zobaczyć. Jednak to podejście nie daje nam bardzo szczegółowego wglądu w rodzaje obecnych agregatów ani ich struktury 3D.
Aby przezwyciężyć ten problem, naukowcy badają wysoce czyste próbki agregatów, które wytwarzają syntetycznie w laboratorium. Nieszkodliwe bakterie są modyfikowane przez naukowców, aby stały się fabrykami białka huntingtyny, produkującymi wiele kopii tej cząsteczki. Naukowcy mogą następnie wyłowić huntingtynę z bakterii i użyć tych próbek do wytworzenia fibryli w probówce, które wyglądają podobnie do tych, które widzimy u ludzi. Fibryle mogą być wykonane z nierozszerzonego białka huntingtyny lub rozszerzonej huntingtyny, odpowiadającej białku huntingtyny z mutacją HD i bez niej. Oznacza to, że naukowcy mogą badać wpływ mutacji HD na fibryle.
Co potężne mikroskopy mogą ujawnić o tych agregatach?
Po wytworzeniu tych syntetycznych próbek fibryli huntingtyny, zespół badaczy ze Szwajcarii przyjrzał się im za pomocą wymyślnego sprzętu zwanego kriogenicznym mikroskopem elektronowym. Ten typ mikroskopu pozwala naprawdę przybliżyć obraz i zobaczyć fibryle w wielu szczegółach. Fibryle są niezwykle małe – tylko 3-10 nanometrów szerokości, około 100 000 razy mniejsze niż grubość twoich paznokci – ale są łatwo widoczne pod tym typem mikroskopu.
W tym badaniu naukowcy zrobili wiele zdjęć fibryli za pomocą mikroskopu, a następnie użyli specjalnego oprogramowania do uśrednienia podobnie wyglądających obrazów. Ten proces uśredniania poprawia jakość obrazu, co sprawia, że cechy fibryli są łatwiejsze do zobaczenia – trochę jak zmiana kontrastu lub jasności na ekranie telefonu, aby lepiej widzieć wyświetlacz.
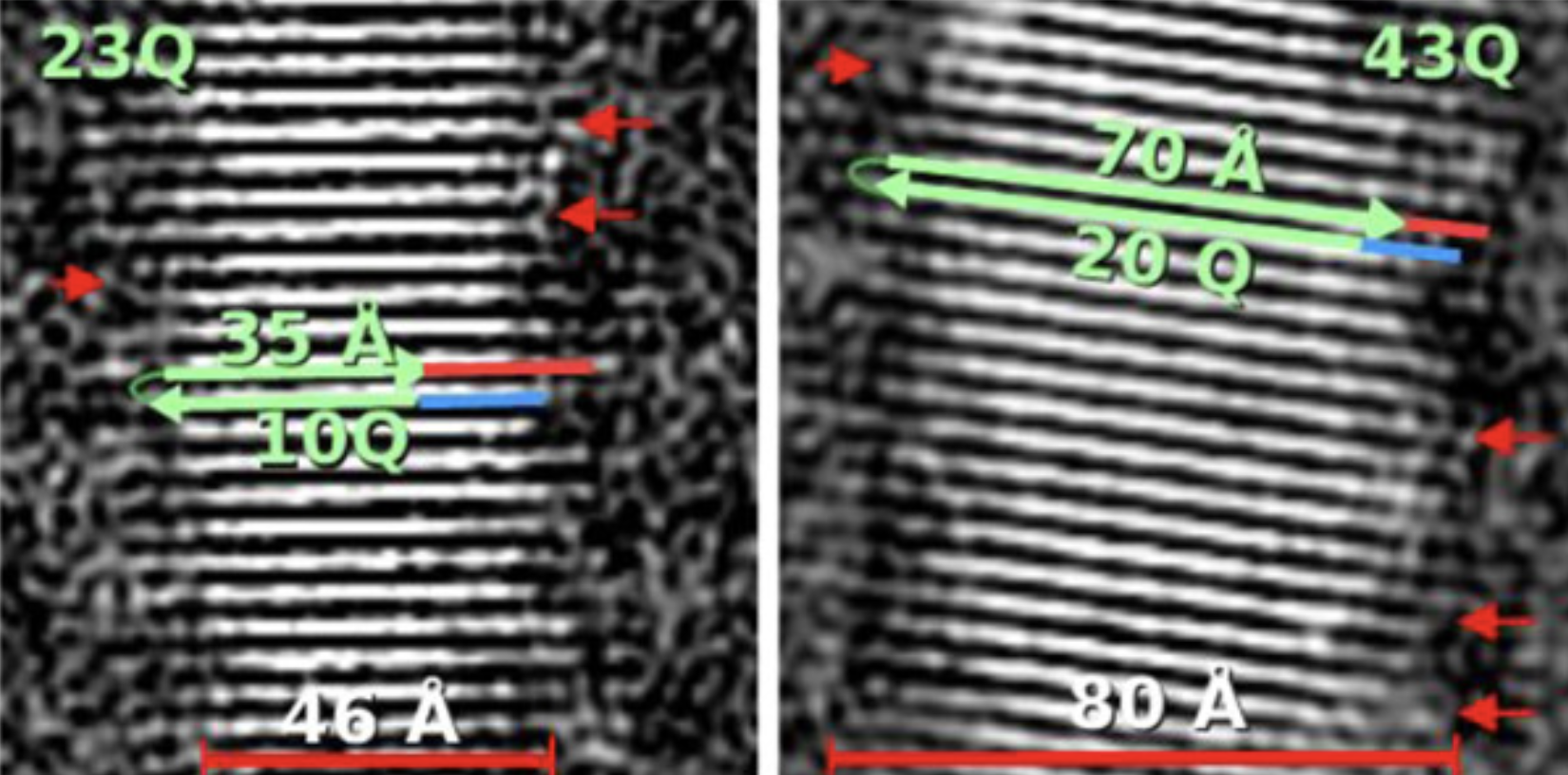
Na podstawie tych obrazów fibryli naukowcy byli w stanie zmierzyć ich wymiary i ustalić, jak wszystkie cząsteczki białka huntingtyny były zorganizowane. Mogli zobaczyć, że były one ułożone w stosy i ustawione w płaskie wstążki, wyglądające trochę tak, jakbyś wziął wiele klocków Jenga i ustawił je wszystkie obok siebie, tworząc cienką, pojedynczą warstwę klocków. Wiele wstążek huntingtyny jest ułożonych jedna na drugiej w fibrylach, co byłoby tak, jakbyś dodawał coraz więcej warstw ustawionych klocków Jenga na wierzchu pierwszej.
Co ciekawe, badacze odkryli, że mutacja HD prowadziła do zmian w wymiarach fibryli białka huntingtyny, a także zmian w liczbie wstążek huntingtyny ułożonych jedna na drugiej. Naukowcy wytworzyli również fibryle z jeszcze mniejszego fragmentu białka huntingtyny, któremu brakuje regionu na samym początku cząsteczki. Wykazali, że te fibryle były znacznie bardziej niezorganizowane i składały się z mieszaniny różnych organizacji cząsteczek białka huntingtyny.
Te odkrycia są ważne, ponieważ pokazują, że mutacja choroby Huntingtona i inne regiony genu huntingtyny wpływają na strukturę 3D i organizację fibryli białka huntingtyny. Fibryle, które są jednolite lub bardziej niezorganizowane, mogą zakłócać funkcjonowanie w różny sposób, więc ważne jest, aby to zrozumieć.
Jak ta praca pomoże osobom dotkniętym chorobą Huntingtona?
Nasze dogłębne zrozumienie struktury agregatów w mózgu w chorobie Huntingtona jest wciąż w pewnym sensie w powijakach, ale możemy spojrzeć na prace w innych obszarach chorobowych, aby zobaczyć, jaką obietnicę może nieść tego typu badanie (poza generowaniem naprawdę fajnych obrazów fibryli oczywiście).
Mutacja w chorobie Huntingtona wpływa na strukturę 3D i organizację fibryli białka huntingtyny
W dziedzinie badań nad chorobą Alzheimera, tego typu podejście jest teraz wykorzystywane do badania fibryli z mózgów pacjentów, którzy zmarli. Ta praca ujawniła zadziwiający poziom szczegółowości struktur fibryli, pokazując dokładnie, gdzie znajduje się każdy atom. Porównując fibryle od osób z różnymi formami choroby Alzheimera, naukowcy mogli zobaczyć subtelne różnice w ich organizacji i wykazali, że istnieją różnice między pacjentami, modelami zwierzęcymi choroby Alzheimera i syntetycznymi fibrylami wytworzonymi w laboratorium. W przypadku innych typów fibryli, które naukowcy badali, zmienność między pacjentami jest znacząca, chociaż nie jest jeszcze jasne, jak to się odnosi do objawów lub nasilenia choroby.
Inne badania pokazują, jak cząsteczki obrazowania mózgu zwane ligandami PET wiążą się z fibrylami. Dziedzina choroby Huntingtona ma ligand PET, który wiąże się z fibrylami (pisaliśmy o tym niedawno na HDBuzz), ale jeszcze nie wiemy dokładnie, gdzie wiąże się on na tych strukturach, więc być może pewnego dnia naukowcy będą mogli wykorzystać to podejście do lepszego zrozumienia ligandu PET.
Ogólnie rzecz biorąc, praca badaczy z EPFL jest ekscytującym krokiem naprzód, gdy zaczynamy lepiej rozumieć fibryle huntingtyny i położyła fundament pod przyszłe badania, w których możemy uzyskać więcej informacji o tej ważnej cesze HD.
Dowiedz się więcej
Więcej informacji o naszej polityce ujawniania informacji znajdziesz w naszym FAQ…


