Konferencja Terapeutyczna Choroby Huntingtona 2020 – Dzień 3.
HDBuzz zdaje raport z dorocznej Konferencji Terapeutycznej Choroby Huntingtona w Palm Springs


Rachel i Sarah zdają raport z Konferencji Terapeutycznej Choroby Huntingtona – największego corocznego zgromadzenia badaczy pracujących nad HD.
Bądź na bieżąco z relacjami z Dnia 1. i Dnia 2..
Czwartkowy poranek – Obniżanie poziomu huntingtyny
Dzień dobry wszystkim! Wracamy do Was z relacją z Dnia 3. spotkania CHDI w Palm Springs, która będzie dotyczyć obniżania poziomu białka huntingtyny. Wielu badaczy oraz firm interesuje się tym tematem!
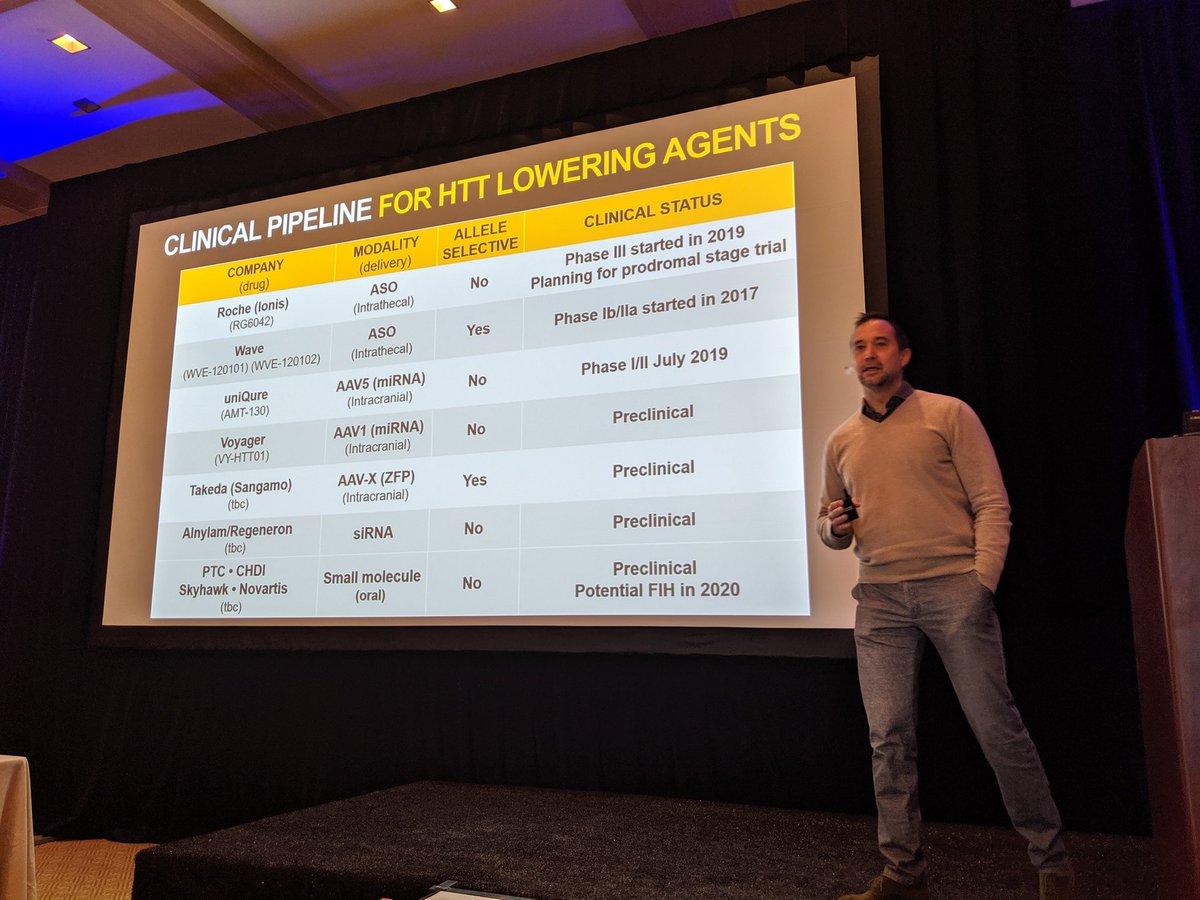
Wiemy, że obniżanie poziomu białka huntingtyny (HTT) u myszy i szczurów pomaga w opanowaniu objawów HD i postępu choroby, a także że możliwe jest obniżenie poziomu HTT u innych zwierząt. Jednak – pytanie za milion – czy jest to możliwe także u ludzi i czy pomogłoby w leczeniu pacjentów? Inne istotne pytania to kiedy powinniśmy obniżać poziom HTT – czy konieczne jest to zanim pacjenci rozwiną objawy, czy później? I czy trzeba przeprowadzić ten proces w konkretnych obszarach mózgu, czy w obrębie całego mózgu? Odpowiedzi na te pytania poszukiwane są obecnie w badaniach klinicznych.
Możemy z optymizmem stwierdzić, że badania kliniczne powinny pomóc nam rozwiać wspomniane wątpliwości. Naukowcy opracowali wiele sposobów na obniżenie poziomu HTT oraz liczne narzędzia do pomiaru poziomów HTT w mózgu. Ponadto w przygotowaniu jest sporo alternatywnych strategii.
Jako pierwszy występuje Ignacio Munoz-Sanjuan z CHDI, omawiający kwestię odpowiedniego czasu na wprowadzenie leczenia obniżającego poziom HTT. Munoz-Sanjuan jest również zaangażowany w niesienie pomocy pacjentom z Ameryki Łacińskiej. W celu dotarcia do pacjentów założył organizację non-profit, która nazywa się Factor H.
Naukowcy chcą mieć pewność, że wszystkie terapie, kóre stworzą, będą bezpieczne dla pacjentów. Choroba Huntingtona wpływa na cały organizm, więc prócz skupiania się na obniżeniu poziomu HTT w mózgu, istotnym jest zrozumienie, jakie efekty da to u pacjenta w całym ciele. Neurodegeneracja jest problemem trudnym do rozwiązania – naukowcy zajmujący się np. chorobą Alzheimera czy Parkinsona również zastanawiają się, jakie podejście będzie najbardziej właściwe w leczeniu. Tworzenie nowych leków nie jest prostym zadaniem i postęp powinien dziać się z zachowaniem ostrożności.
Atrakcyjną koncepcją w kwestii obniżania poziomu HTT są małe cząsteczki. Mowa o lekach, które miałyby być przyjmowane w postaci tabletek, dlatego wiele osób uważa, że to interesująca strategia i warto dalej nad nią pracować. Celem takiego leku nie byłby jednak nadmiar HTT, a raczej HTT ogólnie.
Jednym z kluczowych pytań, jakie również należy sobie zadać jest – kiedy powinno się wprowadzić takie leczenie, by zatrzymać chorobę? Czy możliwe jest odwrócenie już dokonanych uszkodzeń oraz czy możemy stosować takie leczenie w późnych stadiach choroby? Badacze są przeciwni niepotrzebnemu stosowaniu leków, których pacjenci nie musieliby brać bądź nic by to nie dało. Mózg jest naprawdę skomplikowanym narządem i warto pamietać, że mimo iż modele mysie są przydatne dla śledzenia wielu aspektów postępującej choroby Huntingtona, mózg myszy nie jest mózgiem ludzkim. Zastosowanie wielu różnych modeli jest niezbędne, by dokładnie zbadać, jak dobrze mogą działać leki.
Jednakże, myszy wciąż pozostają kluczowe dla badań nad HD. Obecnie gorącym tematem jest zagadnienie, jaki czas jest dobry na wprowadzenie leczenia, dlatego badacze śledzą proces odwracania zmian na poziomie komórkowym u myszy. Dokonali ekscytujących odkryć – obniżenie poziomu HTT u myszy może zapobiegać zmianom bądź wręcz odwracać uszkodzenia neuronów prążkowiowych, które są najbardziej dotkniętymi przez HD komórkami mózgu – wspaniałe wieści!
Kolejnym zagadnieniem są obiecujące biomarkery HD. Dla przypomnienia, są to pomiary, które mogą wykonać naukowcy u pacjentów, by śledzić, jak postępuje choroba. Dobry biomarker może dać lekarzom klinicystom informację o tym, jak najlepiej leczyć pacjenta na dany moment. CHDI spędza dużo czasu na rozwijaniu nowych metod obrazowania, które pomogą zwizualizować, ile HTT jest w mózgu oraz gdzie się znajduje.
Aby tego dokonać, wynaleziono nową cząsteczkę, która łączy się specyficznie z białkiem HTT, gdy przybiera ono konkretną strukturę przestrzenną. Ta cząsteczka nazywa się znacznik PET lub inaczej ligand PET, ponieważ skanery, które rejestrują proces to skanery PET (pozytonowej tomografii emisyjnej). Cząsteczka jest w stanie przedostać się do mózgu, więc mogłaby być wykorzystana do pomocy w śledzeniu, jak przebiega obniżanie poziomu HTT. Na ten moment zespół CHDI dokonuje pomiarów, by zobrazować proces obniżania poziomu HTT u modeli mysich z HD. Podejmowane są próby dokonania tego w różnych obszarach mózgu u myszy w różnym wieku.
Kolejne pytanie, na które starają się odpowiedzieć naukowcy, to jak bardzo powinniśmy obniżać poziom białka HTT w komórkach? Jaki poziom byłby korzystny dla pacjentów? Jaki poziom jest bezpieczny? Możemy wykorzystać ligand PET HTT oraz inne badania, by zmierzyć, jak bardzo obniży się poziom po leczeniu i przy jakim poziomie HTT następuje zdrowienie u danych myszy. Obserwacje modeli mysich mogą być pomocne w zrozumieniu, jak wyglądałoby to u człowieka.
Następne wystęuje Mark Bevan z Northwestern University, który omawia swoją pracę nad obniżeniem poziomu HTT w konkretnym obszarze mózgu.
Badanie, którym dzieli się z nami Bevan, skupia się na tym, jak obniżanie poziomu HTT w danych częściach mózgu może wpływać na sposób, w jaki pracuje mózg, a także jak może to oddziaływać na objawy u pacjentów. Jak wielu innych, Bevan interesuje się zmianami w konkretnych typach komórek w przebiegu HD. Jego zespół odkrył, że u myszy z HD konkretne typy neuronów są mniej aktywne, podczas gdy inne wydają się pozostawać bez zmian.
Obserwując modele mysie, Bevan zaobserwował, że są różnice w tym, jak komunikują się neurony, więc w swoich eksperymentach skupia się również na komunikacji między nimi i tego, jaki wpływ ma na nią obniżenie poziomu HTT u obserwowanych myszy.
Dzięki obniżaniu poziomu huntingtyny, jak wykazał Bevan, deficyty ruchowe zmniejszyły się – myszy są w stanie przebywać dłuższe dystanse z większą szybkością. Jest to wspaniała wiadomość. Obecnie nie ujawniono jeszcze danych o zmianach w zakresie objawów u ludzi, które zbierane są w ramach badań klinicznych. Bevan i jego współpracownicy kontynuują obserwacje swoich modeli mysich pod kątem wpływu obniżania poziomu HTT na deficyty ruchowe. Mają nadzieję, że ich odkrycia dostarczą informacji pomocnych do przewidzenia, jak ta strategia sprawdzi się do celów klinicznych.
Następną prezentację prowadzi Marcy MacDonald z Massachusetts General Hospital, której wystąpienie nosi intrygujący tytuł „The outer limits” („Górne granice”). Dzięki Enroll-HD, badacze dowiadują się, że w HD występuje wiele zmienności, które są wynikiem czynników innych niż długość fragmentów z powtórzeń CAG. Było to wielkie odkrycie w środowisku naukowym skupiającym się na chorobie Huntingtona, jednak wskazuje ono także na to, że nawet jeśli znamy przyczynę genetyczną, ta choroba wciąż pozostaje bardzo złożona. Ogromne podziękowania należą się wszystkim uczestnikom Enroll-HD. Naukowcy robią świetny użytek z danych dostarczanych przez uczestników, co można zauważyć czytając różne doniesienia.
Prócz tego, że gen HTT występuje u wszystkich, a pacjenci z HD mają dłuższe fragmenty powtórzeń CAG, istnieją inne niewielkie zmienności w sekwencji genu HTT, którymi interesują się tacy naukowcy jak MacDonald, chcący z nich uczynić cel terapii.
Zespół MacDonald wygenerował mnóstwo danych na temat tego, co może modyfikować postęp choroby Huntingtona. Wszystkie dane udostępniają naukowcom z całego świata, którzy mogą dzięki temu wspólnie pracować nad tym zagadnieniem – w końcu co dwie głowy, to nie jedna!
MacDonald zidentyfikowała ponadto ludzi, którzy mają obniżoną ekspresję genu HTT. Tym osobom nic nie dolega, stąd badacze wiedzą, że redukcja HTT do przynajmniej takiego poziomu nie będzie mieć szkodliwego wpływu. Poziomy ekspresji genu HTT są różne w obrębie populacji i ludzie nie wydają się mieć objawów w związku z tym – jest to dobra wiadomość w kontekście badań nad strategiami obniżania poziomu HTT. Obserwacje sugerują, że obniżanie poziomu HTT może nie mieć negatywnych skutków ubocznych. Jest jednak rzecz, którą należy mieć na uwadze – u myszy przy obniżonym poziomie HTT (zwłaszcza w wątrobie) komórki są mniej odporne na stres. Dlatego jest to bardzo istotne, by badacze dokładnie zbadali bezpieczeństwo poszczególnych strategii obniżania poziomu HTT.
Z tego powodu, że poziomy ekspresji HTT różnią się w obrębie populacji, należy pamiętać, że początkowe poziomy HTT u pacjentów mogą się różnić. Dlatego można się spodziewać, że w przyszłości podejście do każdego pacjenta będzie indywidualne. Wszystkie te kwestie są brane pod uwagę przez firmy prowadzące testy obniżania HTT podczas projektowania tych badań. Wszyscy oczekujemy z niecierpliwością na więcej wiadomości o tych testach, które usłyszymy podczas sesji popołudniowej.
Czwartkowe popołudnie – obniżanie huntingtyny w warunkach klinicznych
Witamy wszystkich! W tej sesji skupiamy się na obniżaniu poziomu HT w warunkach klinicznych. Pierwsze wystąpienie prowadzi Charlotte SUmner z Johns Hopkins. Będzie omawiać niektóre wyzwania, które wiążą się z obieraniem genów za cel terapii.
Sumner skupia się głównie na innej chorobie neurodegeneracyjnej, jaką jest SMA – rdzeniowy zanik mięśni; obecnie prowadzona jest terapia ASO przeciwko SMA i obserwując ten proces badacze choroby Huntingtona mogą się wiele nauczyć. Podobnie jak w przypadku HD, znamy dokładnie przyczyny genetyczne SMA. Jednak obraz tego, co dzieje się z cząsteczkami białek w obrębie komórki jest dość mglisty, dlatego czynniki warunkujące HD nie są dla nas jasne.

Przyczyny genetyczne SMA są dobrze znane, dlatego stworzono różne terapie genowe. Prócz uznanej już terapii ASO, istnieją również małe cząsteczki (w postaci tabletek), których celem jest obniżenie poziomu ekspresji danego genu – aktualnie FDA poddaje tę formę terapii weryfikacji. Wykazano, że wymiana genu za pomocą jednej dawki – pojedynczego wstrzyknięcia – która bezpośrednio naprawia sekwencję DNA, również działa dobrze u małych dzieci z SMA; trwają prace nad ustaleniem, czy ta metoda leczenia zadziałałaby dobrze na starszych pacjentów. Stan niektórych pacjentów z SMA biorących udział w próbach klinicznych znacząco poprawił się, co wyrażają różne mierzalne parametry.
Są to odkrycia zachęcające dla badaczy skupionych na HD – mamy nadzieję, że będziemy w stanie zastosować skuteczne strategie opracowane celem walki z SMA. Wcześniej podczas tej konferencji pisaliśmy na Twitterze o naukowcach zainteresowanych kwestią optymalnego czasu wprowadzenia leczenia choroby Huntingtona u pacjenta. W odniesieniu do terapii SMA ustalono, że czas jest bardzo istotny, co jest dla nas potwierdzeniem, że badania nad HD idą w dobrym kierunku.
U niektórych pacjentów z SMA zanotowano różnice w reakcji na leczenie, dlatego badacze cieszą się ze wszystkich danych pozyskanych od pacjentów, gdyż pomaga im to zrozumieć, jakie mogą być przyczyny różnic. Ta sytuacja pokazuje, jak pomocne mogą być projekty takie jak Enroll-HD dla badań nad chorobą Huntingtona.
Obecnie naukowcy badający SMA starają się ustalić, jakie są najlepsze metody leczenia i monitorowania pacjentów; zastanawiają się np. w jakiej dawce podawać leki? Kiedy oraz jak często powinny być podawane? Mają nadzieję, że doprowadzi to do poprawy wyników u pacjentów. Podobnie jak w przypadku HD, badacze SMA zainteresowani są białkiem neurofilamentu jako biomarkerem wskazującym na postęp choroby. Monitorują poziom neurofilamentów u pacjentów leczonych za pomocą różnych terapii SMA; poziomy te wydają się spadać z biegiem czasu.
Kolejne występienie prowadzi Anastasia Khvorova z University of Massachusetts Medical School, która porusza temat obniżania poziomu HTT z wykorzystaniem techniki RNAi. Podobnie jak w przypadku ASOs, celem terapii opartych na RNAi jest sygnał do utworzenia HTT, a nie DNA, w którym zakodowane jest białko; leczenie to trafia w pośredni etap syntezy tego białka, przez co nie zostaje ono ostatecznie utworzone. Więcej o RNAi oraz o różnicach między RNAi i ASOs można przeczytać tutaj.
By sprawdzić, jak RNAi celowane w HTT wpływa na przebieg choroby, Khvorova oraz jej zespół najpierw sprawdzili, jakie efekty widać u myszy. Pierwszym krokiem było ustalenie, jak szeroko to leczenie objęło mózg – wyniki są bardzo obiecujące! Po leczeniu wykazano, że poziom HTT w wielu obszarach mózgu obniżył się. Celem była zarówno HTT w ilości normalnej oraz zwiększonej, jednak naukowcy starają się wypracować takie podejście, które celowałoby wyłącznie w huntingtynę o zwiększonym poziomie. Dostosowując cząsteczki RNAi w sprytny sposób, Khvorova i jej współracownicy byli w stanie sprawić, by leczenie stało się selektywne i zatrzymywało sygnały do utworzenia HTT w zwiększonej ilości, by tylko w takim przypadku poziom był obniżany – nie, gdy wyjściowo jest dobry. Warto jednak zauważyć, że zadziała to tylko u ok.35% pacjentó, u których występuje pewna różnica w sekwencji genu kodującego huntingtynę, nazywana SNP („snip”). Obecność SNP sprawia, że metoda z użyciem RNAi może zadziałać silniej na HTT, jeśli jest w nadmiarze niż gdy jest na dobrym poziomie.
Następnym krokiem miało być sprawdzenie, jak leczenie RNAi zadziała u większych zwierząt, dlatego badacze skupili się na owcach. Przetestowali wiele różnych dróg podania leku i dowiedli, że efekt wstrzyknięcia go do mózgu oraz podania do płynu mózgowo-rdzeniowego będzie taki sam.
Po badaniach na owcach, Khvorova oraz jej zespół zaczęli badać małpy i ponownie zauważyli, że RNAi odpowiednio rozprzestrzenia się w mózgu i rdzeniu kręgowym. W tych obszarach pozostaje w pożądanej formie przez dosyć długi czas, dlatego nie spodziewają się, by była konieczność podawania leku zbyt często. Bardzo wczesne badanie bezpieczeństwa u wspomnianych małp wykazało, że terapia wydaje się być bezpieczna – przy zastosowaniu dawek, jakich użyto do testów.
Podobnie badanie bezpieczeństwa wykazało, że terapia (w konkretnych warunkach testów) była bezpieczna także dla owiec. Obiecująca wiadomość jest taka, że poziom HTT obniżył się istotnie na etapie wczesnych badań u małp. Poziomy ekspresji innych genów pozostały niezmienione, co znaczy, że w warunkach tego eksperymentu nie zanotowano znaczących efektów ubocznych leczenia bądź zadziałania leku na niewłaściwy cel. Mimo to, nadal ważne jest, by przyglądać się innym genom pod kątem choćby najmniejszych zmian, dlatego Khvorova wraz z zespołem nadal pracują nad tym, by upewnić się, że nie ma znaczących różnic i terapia jest bezpieczna.
Zarówno Khvorova ze współpracownikami, jak i CHDI, uważają tę technologię za niezwykle obiecującą. Mogłaby być wykorzystana do zmiany poziomów także innych białek w obrębie mózgu, np. tych, które mają udowodniony wpływ na zapoczątkowanie objawów u pacjentów z HD, lecz nie tylko. Jedna z kwestii, na które zwracają uwagę, to koszty. Starają się, by nie były one zbyt wysokie, tak by leczenie było dostępne dla wszystkich pacjentów z HD. Nie możemy doczekać się, aż ta technologia będzie testowana w warunkach klinicznych i usłyszymy nowe wieści!
Następnie występuje Astrid Valles-Sanchez z uniQure. Będzie opowiadać o podejściu uniQure do kwestii obniżania poziomu HTT. Lek uniQure mający obniżać HTT nazywa się AMT-130 i obecnie jest testowany klinicznie pod kątem bezpieczeństwa. Terapia AMT-130 ma polegać na jednorazowym wstrzyknięciu do mózgu leku mającego obniżać poziom HTT.
Valles-Sanchez skupia się w swoim wystąpieniu na biomarkerach, których pomiary pomagają ocenić, jak efektywne jest to leczenie w modyfikacji postępu HD. Badania na świniach wykazały, że lek utrzymywał się w płynie mózgowo-rdzeniowym do 2 lat. U małp utrzymywał się do 6 miesięcy, następnie zwierzęta zostały uśpione. Podobnie jak w innych przypadkach, uniQure chce upewnić się, że lek rozchodzi się w mózgu oraz sprawdzić, w których jego obszarach działa. U świń po 12 miesiącach od podania leku przeanalizowano tkanki z różnych części mózgu, by sprawdzić efektywność obniżenia poziomu HTT. Wykazano istotne obniżenie HTT o wyjściowo podwyższonym poziomie, zwłaszcza w rejonach mózgu najbardziej dotkniętych wpływem choroby Huntingtona. uniQure sprawdzili też poziomy HTT w płynie mózgowo-rdzeniowym po leczeniu, jednak w warunkach tego eksperymentu nie wystąpiła zależność między poziomem HTT w mózgu, a poziomem HTT w płynie mózgowo-rdzeniowym. Naukowcy z uniQure zamierzają zastosować MRS – spektroskopię rezonansu magnetycznego – nieinwazyjną metodę oceny mózgu, by sprawdzić, czy po leczeniu zaszły zmiany związków chemicznych zwanych metabolitami, występujących w różnych obszarach mózgu.
Ostatnia prezentacja na tej konferencji jest autorstwa Scotta Schobela, który opowiada o nowych wstępnych wynikach z badania Roche. Wyniki te pochodzą z 15-miesięcznego badania typu open label – badania klinicznego z próbą otwartą, które dotyczyło objawowych pacjentów z chorobą Huntingtona; ze względu na to, że są to bardzo wczesne dane, trzeba je interpretować z dużą ostrożnością, ale ciekawie jest o nich posłuchać i dowiedzieć się, czego jak dotąd dokonano.
Tak jak wiele projektów z dziedziny badań nad HD, był to ogromny wspólny wysiłek wielu badaczy. RG6042 ma nową nazwę! Nazywa się tominersen i odtąd ta nazwa będzie używana w odniesieniu do tej terapii. Pacjenci, którzy brali udział w badaniach mających określić bezpieczeństwo tominersenu, zostali objęci rozszerzeniem tego badania, jakim jest badanie typu open label – oznacza to, że po próbie bezpieczeństwa nadal otrzymywali ten lek; dane, które zostały przedstawione, to informacje zebrane od momentu zakończenia badań nad bezpieczeństwem. Co istotne, to leczenie NIE jest selektywne w stosunku do genu HTT o zwiększonej ekspresji, lecz jest zaprojektowane tak, że obniża poziom białka huntingtyny ogólnie, niezależnie od tego czy był on nieprawidłowo zwiększony.
Firma Roche oraz jej współpracownicy pracowali na różnych modelach zwierzęcych przez wiele lat celem ustalenia, jak bardzo powinni obniżać poziom białka huntingtyny i jak mogą zmierzyć stopień obniżenia HTT badając płyn mózgowo-rdzeniowy. Dwa lata temu na spotkaniu CHDI Sarah Tabrizi z UCL przedstawiła pierwsze wyniki badań bezpieczeństwa. W 2 lata dokonał się wielki postęp w dziedzinie obniżania poziomu HTT, przez co obecnie jest dostępnych wiele strategii – to bardzo ekscytujące!
Z badań bezpieczeństwa można było wywnioskować, że poziomy białka HTT można było obniżyć za pomocą tominersenu proporcjonalnie do jego dawki. Oznacza to, że, z niewielkiej grupy badanych pacjentów, u tych, którzy otrzymywali lek w większej dawce, zanotowano większy spadek poziomu HTT. W przedłużeniu tego badania, w postaci badania klinicznego z próbą otwartą, testowano 2 strategie dawkowania leku – pacjenci dostawali lek albo co miesiąc, albo co drugi miesiąc. Ten sposób zaprojektowania badania był kluczowy dla ustalenia, jak często pacjenci musieliby brać tominersen.
Zaobserwowano, że dobry efekt w zakresie obniżenia poziomu huntingtyny uzyskano już przy podaży tominersenu co drugi miesiąc. Bardzo niewielu pacjentów z obu grup nie ukończyło przedłużenia badania, większość owszem – jesteśmy bardzo wdzięczni pacjentom za poświęcenie, którym się wykazali na rzecz tego badania!
Wstępne wyniki badania firmy Roche wskazują na to, że tominersen powinien być podawany pacjentom raczej co drugi miesiąc niż co miesiąc. Przez to, że naukowcy ustalili, że mniejsza częstotliwość podaży leku daje wystarczająco skuteczne obniżenie HTT, zmodyfikowali strategię następnego etapu badania – fazy III, obniżając liczbę dawek oraz testując skuteczność podawania leku co 16 tygodni, co byłoby znacznie mniej wymagające dla pacjentów!
Pomiary poziomów białka neurofilamentu, czyli biomarkera proponowanego do śledzenia progresji HD, mogłyby być pomocne, by wykazać, jak skuteczne jest leczenie – zatem w warunkach badania klinicznego Roche wciąż dokonuje tych pomiarów. Wykazano, że poziomy NfL początkowo wzrosły, lecz następnie zaczęły się zmniejszać i wyrównywać do czasu ok. 15 miesięcy. Zespół z Roche chce głębiej zrozumieć znaczenie biomarkeru NfL, więc zagłębia się w podstawy biologiczne, które mogą łączyć HTT z NfL. W przygotowaniu przez Roche jest więcej badań klinicznych i mamy nadzieję, że będą one stanowiły dla badaczy HD źródło informacji o efektywności tej terapii.
Scott Schobel podzielił się swoją prezentacją w formie online i można ją znaleźć tutaj – dziękujemy!
To wszystko, jeśli chodzi o tegoroczną Konferencję Terapeutyczną HD! Zachęcamy do zapoznania się z relacjami z Dnia 1. i Dnia 2., a także z dyskusjami na Twitterze.
Mamy nadzieję, że zamieszczone informacje są dla Was pomocne i pomagają Wam być na bieżąco. Już teraz cieszymy się na konferencję w przyszłym roku!
Więcej informacji o naszej polityce ujawniania informacji znajdziesz w naszym FAQ…