
Konferencja Terapeutyczna Choroby Huntingtona 2015 – Dzień 1
Konferencja Terapeutyczna Choroby Huntingtona 2015 w Palm Springs – Dzień 1

The first of our special reports from the Annual Huntington’s Disease Therapeutics Conference in Palm Springs – the biggest meeting of HD scientists focused on developing treatments to prevent or slow Huntington’s disease.
Monday evening: introductions
In an introductory session, CHDI Foundation is presenting updates on its work to develop therapies for HD http://chdifoundation.org/.
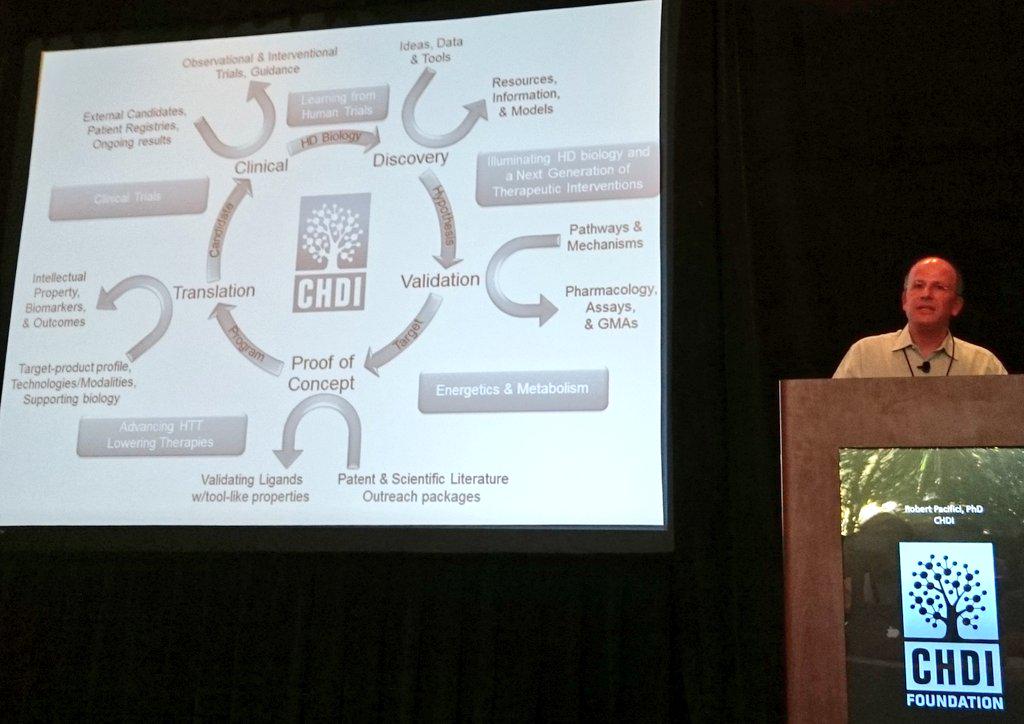
Kicking off is Dr Robert Pacifici, CHDI Foundation’s Chief Scientific Officer CHDI is a non-profit foundation that aims to rapidly develop treatments to prevent or slow Huntington’s disease. Because CHDI is a non-profit foundation it does not have to answer to shareholders, enabling it to focus on a single disease: HD. CHDI partners with academic researchers, private research organizations & drug companies 2 advance HD research on as many fronts as possible.
Pacifici outlines CHDI’s „soup to nuts” science strategy to Huntington’s disease therapeutics research. (The expression „soup to nuts” means start to finish. We don’t know who finishes a meal with nuts either but apparently it’s a real thing). An important part of CHDI’s work is repeating work done by other researchers. If the result’s different, a rethink may be needed. This 'replication’ is an important part of science but often overlooked because it’s not terribly glamorous. It’s great that CHDI’s doing it.
CHDI’s programs include huntingtin lowering, TrkB activation, KMO inhibition, PDE inhibition and others. Pacifici: „CHDI Foundation has much to be proud of, but much more important work to do before we have satisfied our patients’ unmet needs”.
Dr Cheryl Fitzer-Attas, CHDI’s Vice President, Clinical Research, presents the Foundation’s patient-centred efforts. Cool new CHDI collaborations include wearable tech and automated speech analysis to study the progression of HD. CHDI puts a lot of effort into developing the best tools to assess signs & symptoms of HD, to be used for clinical trials.
PEARL-HD is a CHDI-supported brain scan study using special brain scans 2 help test PDE-inhibitor drugs. Thinking ahead, CHDI is studying HD’s „burden of illness” – very helpful in getting healthcare systems to pay for new drugs. Bottom line: caring for HD patients is very expensive, so if new drugs can improve things, insurance companies and health providers will save money.
CHDI’s biggest clinical HD study is Enroll-HD. Enroll-HD aims to enable clinical research, help understand HD and improve clinical care.
Tuesday morning: connections
Hongwei Dong uses amazing microscope and computer techniques to map out the trillions of connections between brain cells. His beautiful work can be seen here: http://www.mouseconnectome.org/gallery/. No brain cell is an island, the connections between brain cells are the critical place where brain cells do their computations. Using normal mice, Dong’s team has been mapping connections between two important parts of the brain called the cortex and the striatum. The cortex and striatum are the parts of the brain most affected in HD, these kinds of maps could be a useful tool to understand the disease. Dong’s team is now working with HD mice and comparing them to normal mice. They find a breakdown in communication between these regions.
Myriam Heiman is interested in studying the different types of cells that make up the striatum, the vulnerable part of the brain in HD. Not all cells in the HD brain die at the same rate – if we can figure out why, we might be able to learn some tricks from protected cells. Heiman’s lab has developed a cool new technique they call SLIC to study the function of individual genes in the brains of living mice. Their technique lets Heiman’s team study a million cells in each experiment, so they can study the effect of many genes in each experiment. When they got rid of one gene, called Gpx6, HD brain cells died.
“We have much more important work to do before we have satisfied our patients’ unmet needs”
This suggests that whatever Gpx6 is doing is helpful for HD cells. Not much is known about what Gpx6 is normally doing in the brain, so Heiman’s team is working to figure out what the role of this gene is. This kind of work is an important way to generate new leads – if we can find ways to boost Gpx6 activity we might protect HD brain cells. Given this success, Heiman’s team is expanding their study to look at much greater number of genes. What other targets are out there?.
Juan Botas, from Baylor, uses fruit flies to study HD! Why use flies? They’re cheap, breed quickly and allow us to do quick studies. HD Scientists are generating so much data that it’s hard to know which changes that happen in HD are an important part of the disease. Some changes happening during the course of the disease might actually be the body trying to protect itself, which we don’t want to stop. Given the huge amount of data to follow up on, the team has turned to tiny fruit flies to ask if each change is good, bad, or indifferent. Because flies don’t normally get HD, Botas’ team has genetically modified a strain – giving them a mutant HD gene. Flies that have a mutant HD gene have a number of changes – they even have movement problems, becoming quite clumsy compared to normal flies.
Because many scientists work on fruit flies, a huge number of genetically modified genes are available to study. Botas team is able to use flies that have extra, or fewer, copies of a huge number of genes, breeding them to their HD flies. These hybrid flies allow the team to figure out which changes are part of the problem in HD, and which might be protective responses. Now Botas is working to validate his teams findings in flies in human brain cells, because of course no one is interested in treating flies!.
Jong-Min Lee from Massachusetts General is presenting his work on genetic modifiers of Huntington’s disease. Genetic modifiers are natural genetic variations between people, that can speed up or slow the progression of HD. Studying genetic variations enables us to understand „mother nature’s experiments on humans”. Technology lets us study the whole genome to look for genetic modifiers of HD. These are called genome-wide association studies (GWAS). If you have lots of DNA samples, it’s easy to find 'candidate’ genetic modifiers. Proving what exact genes affect HD is the tricky bit.
One problem is that because DNA is passed down generations in big chunks, even the best technologies only highlight general regions. Once a GWAS study has highlighted a region of DNA that appears linked to HD progression, the hard bit is proving what gene is important. Using 8000 samples donated by HD patients, two candidate genetic modifiers have been found on chromosome 15. (A chromosome is one of the 46 blobs of DNA that make up our genome). There’s another candidate genetic modifier on chromosome 8, and another on chromosome 3. The candidate genetic change on chromosome 15 has an effect equivalent to changing age of HD onset by 6 years.
Of course, we can’t change people’s DNA, but maybe we could develop drugs to mimic naturally protective genetic variations or block bad ones. One candidate points to a problem with the machinery cells use to repair damaged DNA. Lee and his team are now doing the hard bit – looking at all the individual genes in the candidate regions, to figure out the important ones. That involves much messier work in the lab using cells and other models of HD, to see whether changing genes affects the disease.
Jim Rosinski, CHDI, is a computational biologist. He’s helping the foundation understand and use the huge amount of data they’re generating. It’s gotten easy for scientists to conduct experiments that result in massive data sets, which are hard for the average scientist to use. CHDI is generating a massive amount of measurements on animal models of HD, and making these data available to everyone. Rosinski’s team has looked at a number of organs in HD mice, in addition to the brain, and finds a number of surprising changes. Tissues like the liver and fat tissue show a number of early changes, suggesting HD has effects everywhere.
CHDI is analyzing all these changes with a number of computational experts, trying out a range of modeling approaches to explain the data. The results of one of these efforts are starting letting CHDI scientists to make predictions, which they’re testing in the lab now. CHDI is releasing all the data they’re generating to a website: http://HDinHD.org , where any interested scientist can download it.
Tuesday afternoon: energy

This afternoon’s session focuses on the problem of „energetics” in HD; cells from HD people and animals seem to inefficiently make energy.
Michael Orth describes the work of a group of investigators working on a project called „Multi-Tissue Molecular Signatures in HD”. The team has isolated muscle, fat and skin cells from a large group of HD mutation carriers, trying to map their energy usage in fine detail. Orth reports that there are changes in mitochondria, the power plants of the cell, in muscle cells from HD patients. These changes were especially seen when the cells were stressed by chemical treatments that „stress” the mitochondria.
Next Martin Brand of the Buck Institute presents more on energy and mitochondria in Huntington’s disease. Brand extracts mitochondria from HD model mice and studies how they work in the lab. After studying the mitochondria carefully, Brand found no difference in the way mitochondria behave in the HD mice. That’s somewhat surprising because previous scientists had found abnormalities of mitochondrial functioning in HD.
Next Brand studied levels of 'reactive oxygen species’ in HD mouse brain cells. Reactive oxygen species are chemicals that can damage cells through reacting with them. (Antioxidants are chemicals that protect cells against these reactive oxygen species.). Damage from reactive oxygen species has been suggested as one way HD causes damage, and antioxidants suggested as possible therapies. Unexpectedly, cells with the HD mutation seemed to have BETTER resistance to reactive oxygen species. This is a very unexpected finding – you can bet a lot of scientists are scratching their heads over this one.
Doug Rothman, Yale, uses MRI machines to analyze energy usage in the brains of living mice and people. Volunteers in these studies have injections of chemically modified sugar, which lets scientists track the fate of this sugar in the brain. This technique lets scientists watch sugar get processed in real time, so we can see how HD brains make and use energy. Our brains are constantly using an enormous amount of sugar for energy all the time – whether we’re actively engaged in a task or not. Rothman’s team sees large changes in the rate of sugar consumption in the brains of HD mice. The kinds of measurements Rothman’s team is using can easily be used in human HD patients.
Ryan Michalek, of Metabolon, specializes is measuring the concentrations of the thousands of chemicals that make up cells. They’re using HD animal models to look for common patterns of chemical change. Among the thousands of chemicals and reactions that make cells work, they’ve discovered dozens that are altered in HD.
This afternoon’s talks added a huge amount of information to what we already knew about how HD tissues are different than normal tissues.
Larry Park, of CHDI, summarizes the talks and controversies of the day. In particular, good evidence supports the idea that oxidative stress is part of HD. CHDI is investigating a protein called Nrf2. Nrf2 is the cell’s master regulator for responding to oxidative damage, helping cells marshal their defences in response to damage.
Więcej informacji o naszej polityce ujawniania informacji znajdziesz w naszym FAQ…


