
Konferencja Terapeutyczna Choroby Huntingtona 2021 – Dzień 2
Śledź wszystkie najnowsze wiadomości z 2. dnia Konferencji Terapeutycznej Choroby Huntingtona CHDI 2021 #HDTC2021
Wracamy z drugim dniem wirtualnej Konferencji Terapeutycznej CHDI 2021. Ten artykuł podsumowuje nasze najnowsze, ekscytujące wiadomości naukowe prezentowane na bieżąco na Twitterze, które możesz śledzić za pomocą hashtagu #HDTC2021.Poranna sesja koncentrowała się na obiecujących terapiach HD w przedklinicznych fazach badań, a na sesji popołudniowej omówione zostały różne biomarkery choroby Huntingtona.
Co pojawi się wkrótce, jeśli chodzi o nowe leki w terapii choroby Huntingtona
Oprócz wszystkich badań klinicznych nad chorobą Huntingtona, będących obecnie w toku, wielu naukowców wciąż poszukuje i opracowuje nowe i innowacyjne sposoby leczenia HD. Podczas tej sesji podkreślono niektóre z tych obiecujących metod.
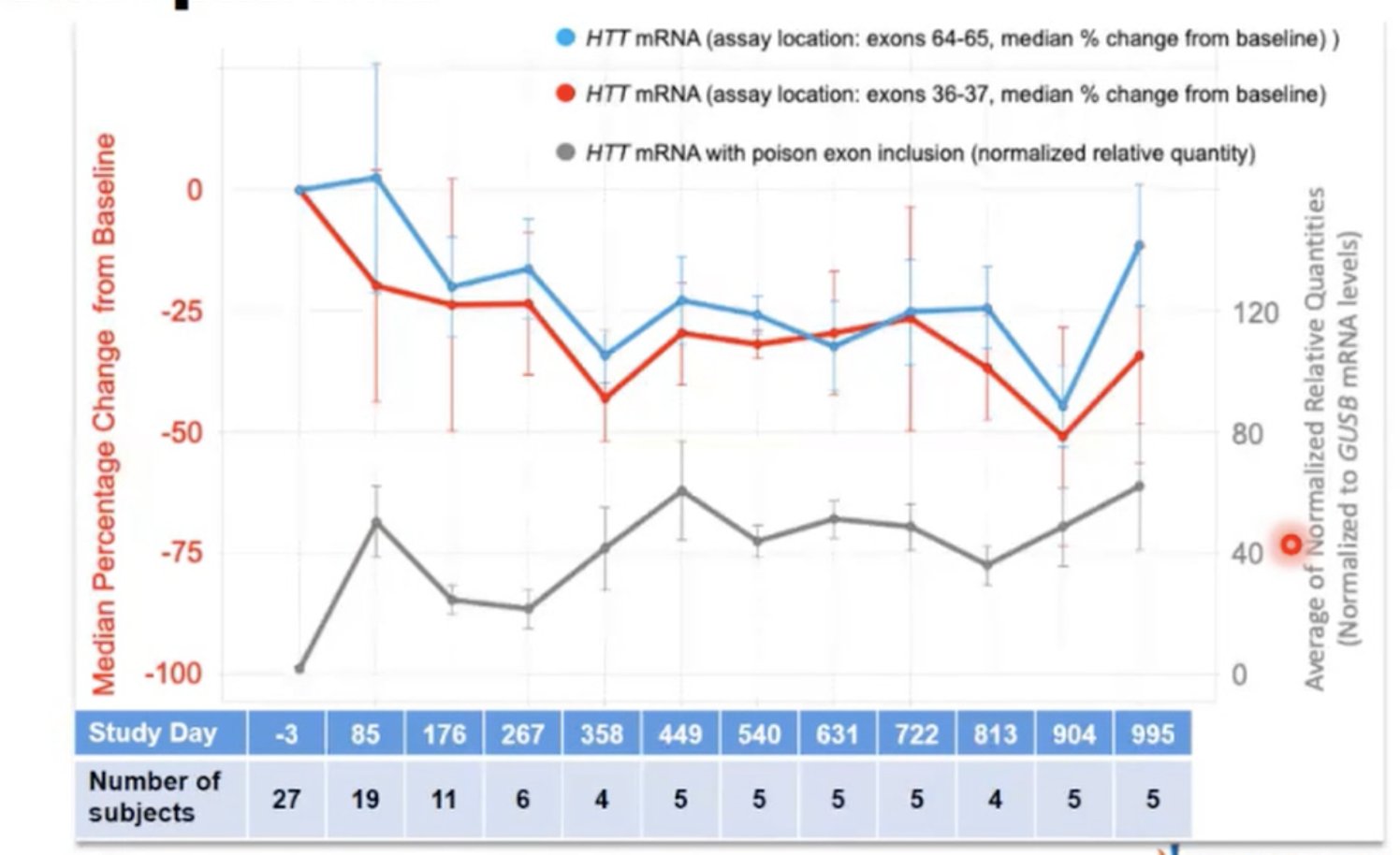
Image credit: Novartis
Naprawianie oczyszczającego systemu w naszych komórkach, aby pozbyć się toksycznych skupisk białka huntingtyny
Jako pierwszy wystąpił Peter Hamley z Samsara Therapeutics, który omawiał małe cząsteczki zwiększające autofagię, czyli rodzaju systemu oczyszczającego nasze komórki. Komórki mózgu mogą wykorzystywać autofagię do usuwania zanieczyszczeń, w tym toksycznych, patologicznych białek, takich jak zmutowana huntingtyna. Projektowanie leków zwiększających usuwanie huntingtyny to kolejna metoda ochrony komórek mózgu. Autofagia jest powiązana ze starzeniem się na wiele różnych sposobów; wzmocnienie autofagii za pomocą różnych narzędzi może zwiększyć długość życia zwierząt w laboratorium i może być stosowane w leczeniu chorób związanych z wiekiem, takich jak choroba Huntingtona.
Samsara wykorzystuje proces przesiewowy w celu znalezienia cząsteczek, które zwiększają autofagię, a następnie testują otrzymane związki, aby sprawdzić, czy mogą one poprawić usuwanie toksycznych białek. Korzystając z platformy przesiewowej, Samsara zidentyfikowała kilka interesujących związków, które mogą zwiększyć autofagię w komórkach i u myszy. Związki te wydają się działać lepiej, niż wcześniej odkryte leki i substancje chemiczne wzmacniające autofagię, a także wyglądają obiecująco w innych modelach neurodegeneracyjnych, takich jak choroba Alzheimera. Niedawno Samsara zastosowała swoje badania do choroby Huntingtona i wykazała, że ich związki działają ochronnie w komórkach HD i u much. Hamley ma nadzieję, że zidentyfikują i rozwiną ich najlepszą cząsteczkę w najbliższej przyszłości, z myślą o wyznaczeniu kandydata na lek do dalszych testów w 2022 roku.
Małe cząsteczki obniżające poziom zmutowanej huntingtyny
Następnie wystąpiła Beth Hoffman z Origami Therapeutics (trafnie nazwanej) firmy, która koncentruje się na zwijaniu i nieprawidłowym fałdowaniu białek. Ze względu na dodatkowe powtórzenia CAG, wydłużona huntingtyna fałduje się w inny kształt, co może być przyczyną tego, że łatwiej ulegnie pocięciu na toksyczne fragmenty. Origami Therapeutics opracowuje małe cząsteczki, aby wspierać usuwanie tych fragmentów szkodliwej huntingtyny. Mają nadzieję znaleźć małe cząsteczki, które albo uruchomią komórki do pozbycia się szkodliwej huntingtyny, albo skorygują jej kształt, stabilizując jej strukturę 3D, aby stała się mniej szkodliwą.
Proces przesiewowy Origami ocenia odkładanie się wydłużonej huntingtyny, a także szkodliwe skutki, które ich zdaniem są spowodowane toksycznymi skupiskami tego białka. Ich celem jest zidentyfikowanie małych cząsteczek, które naprawią te problemy, a następnie określenie najlepszego poziomu dawki i czasu dostarczenia ich do komórek. Niektóre ze związków, które zidentyfikowali, mogą obniżyć poziom szkodliwej huntingtyny w komórkach, podczas gdy inne uważa się za stabilizujące jej strukturę, czyniąc ją mniej szkodliwą. Ogólnie rzec biorąc, strategia Origami polega na określeniu, które związki są najbardziej pomocne, a następnie cofaniu się, aby zrozumieć, w jaki sposób dokładnie działają na białko huntingtynę.
Zastępowanie chorych komórek podporowych w mózgu HD
Następnym mówcą był Steve Goldman, naukowiec akademicki, który bada strategie leczenia HD poprzez zastępowanie komórek podporowych mózgu (gleju) zdrowymi komórkami, nieposiadającymi mutacji HD. Często mówimy o utracie neuronów w HD, ale dotyczy to również podporowych komórek mózgu.
Badania Goldmana mają na celu sprawdzić, czy utrata gleju może powodować część objawów HD. On i jego zespół pobierają komórki glejowe produkujące toksyczne białko huntingtynę, wszczepiają je myszom, a następnie przeprowadzają różne doświadczenia, aby sprawdzić, jak wpływa to na myszy. Rozwijają się różne objawy i nieprawidłowości w mózgu w porównaniu z myszami kontrolnymi.
Goldman bada również ludzkie komórki hodowane w szalkach, aby sprawdzić różnice pomiędzy glejem wykazującym ekspresję genu HD, a tym który nie wykazuje ekspresji tego genu. Glej z mutacją HD wykazuje wiele zmian w genach, które „włączyli” lub „wyłączyli”, a komórki mózgowe otoczone przez glej HD także nie działają. Jeden specyficzny rodzaj gleju, nazwany astrocytami, wykazuje zmiany w kształcie, rozwoju i stanie zdrowia, jeżeli mutacja HD jest obecna.
Zespół badawczy Goldmana chciał dowiedzieć się, czy wszczepienie zdrowych komórek glejowych myszy z HD może u niej złagodzić objawy HD. W swoich eksperymentach wykazali, że myszy z implantami zdrowych komórek glejowych miały nieco łagodniejsze objawy behawioralne i dłuższe życie. Długoterminowym celem laboratorium jest możliwość przejścia do testowania przeszczepów komórek glejowych w ludzkim mózgu, a Goldman pracuje nad zaplanowaniem badania klinicznego fazy I/II. Takie badanie wymagałoby specjalnego gleju klasy medycznej, nieco innego niż ten, który bada większość naukowców, nad czym Goldman również pracuje. Pozostaje jeszcze trochę pracy zanim badanie na ludziach zostanie zrealizowane i nie jest jeszcze jasne, jak będzie wyglądał harmonogram tego projektu, ale jest to interesująca strategia.
„Oprócz wszystkich badań klinicznych nad chorobą Huntingtona, które są obecnie w toku, wielu badaczy wciąż poszukuje i rozwija nowe i innowacyjne metody leczenia HD”
Od rdzeniowego zaniku mięśni do terapii HD
Jako ostatni w tej sesji wystąpił Rajeev Sivasankaran z Novartis. Omówił lek o nazwie branaplam, który można przyjmować doustnie, aby obniżyć poziom białka huntingtyny. Możesz również sprawdzić nasz poprzedni artykuł HDBuzz na temat branaplam i HD
Zainteresowanie Novartis chorobą Huntingtona rozpoczęło się od innej choroby neurodegeneracyjnej, rdzeniowego zaniku mięśni (SMA), które powoduje ciężkie osłabienie mięśni u dzieci. Podobnie jak HD, SMA jest dziedziczone, ale w przeciwieństwie do HD, jest spowodowane brakującym białkiem, a nie obecnością toksycznego białka. W leczeniu SMA Novartis opracowało branaplam, lek przywracający brakujące białko poprzez modulację składania.
Branaplam pozwala komórkom „włączyć” inny gen, którego białko może zastąpić brakującą funkcję. Ten gen jest zwykle uśpiony, ale branaplam przywraca jego aktywność. Branaplam testowano u ludzi i działał ogólnie dobrze. Nadal jest badany, ale jak dotąd wydaje się działać dobrze u dzieci z SMA.
Co to ma wspólnego z HD? Branaplam działa poprzez zmianę składania mRNA, czyli kopii roboczej lub „receptury” genu, która jest tworzona w procesie wytwarzania białka. Okazuje się, że sposób w jaki działa ten lek w celu aktywacji ratującego genu w SMA, może również sprawić, że będzie on aktywny na „recepturze” dla białka huntingtyny. Szczęśliwym zbiegiem okoliczności gen huntingtyny zawiera tę samą sekwencję w miejscu, w którym działanie branaplamu może zmniejszyć produkcję białka. Branaplam działa poprzez wymuszenie wstawienia sekwencji, która normalnie zostałaby usunięta- sekwencji, która mówi „przestań wytwarzać to białko”. Efekt branaplamu jest trochę jak dodanie do książki brakującego rozdziału, który mówi „przestań czytać tę książkę”.
Ale czy to rzeczywiście działa w żywych organizmach? Tak, w każdym razie u myszy z ludzkim zmutowanym genem HD. Sivasankaran przedstawił dane pokazujące, że poziom huntingtyny spada po 3 tygodniach od leczenia branaplamem, a następnie ponownie wzrasta.
I oczywiście branaplam został już przetestowany u dzieci z SMA! W badaniu klinicznym poziom huntingtyny u dzieci leczonych branaplamem spadł o około jedną trzecią, a następnie pozostał niski. Novartis jest na zaawansowanym etapie planowania badania klinicznego branaplamu na ludziach z chorobą Huntingtona, ale żadne szczegóły tego badania nie zostały ujawnione dzisiaj. Podczas pytań i odpowiedzi Sivasankaran zasugerował, że więcej informacji na temat programu tego badania będzie ujawnionych „w nadchodzących tygodniach” i „latem”.
Biomarkery dla programów obniżających poziom huntingtyny
Podczas dzisiejszej sesji popołudniowej wysłuchaliśmy naukowców pracujących nad biomarkerami choroby Huntingtona. Biomarkery to różne sposoby, dzięki którym naukowcy mogą dokładnie śledzić progresję HD i sprawdzać, czy terapie obniżające poziom huntingtyny są skuteczne.
Obrazowanie mózgu w celu wykrycia poziomu zmutowanej huntingtyny
Daniele Bertoglio rozpoczął od opisu swoich badań, które mogą pomóc w pomiarze szkodliwej huntingtyny za pomocą nieinwazyjnych metod obrazowania mózgu. Jego zespół rozwija zaawansowane narzędzia obrazowania w nadziei, że będą mogli wykryć poziom białka huntingtyny w mózgach pacjentów z HD.

Obecnie możemy pośrednio mierzyć poziom huntingtyny w mózgu, badając płyn mózgowo- rdzeniowy (PMR), który otacza mózg- omówiliśmy to wcześniej tutaj. Zespół Bertoglio pracuje nad strategią, która wykorzystuje chemiczne znaczniki, które przyczepiają się do białka huntingtyny w mózgu. Są one lekko radioaktywne, więc mogą być wykryte za pomocą urządzenia, które wykonuje skanowanie za pomocą pozytonowej tomografii emisyjnej (PET). Skanery PET są szeroko stosowane w klinikach medycznych na całym świecie, chociaż nigdy nie były używane do pomiaru poziomu huntingtyny, ponieważ każda nowa aplikacja skanera PET wymaga nowego znacznika chemicznego, który może być wstrzykiwany osobom poddawanym obrazowaniu.
Wykorzystując myszy, u których zastosowano leki obniżające poziom białka huntingtyny, zespół Bertoglio testuje nowy znacznik huntingtyny. Myszy z niższym poziomem huntingtyny miały niższy sygnał na skanerze PET, tak jak się spodziewali. Przy użyciu różnych technik zespół badał również myszy, u których poziom huntingtyny był obniżony na małym, ograniczonym obszarze, a także szerzej. Znacznik PET Huntingtyny działa w obu przypadkach, co sugeruje, że można go wykorzystywać do wykrywania obu rodzajów obniżenia.
Bertoglio podczas pytań i odpowiedzi, wspomniał także, że jego zespół przetestował ten nowy znacznik w przekazanej tkance mózgowej od donatorów HD, w której można zobaczyć wiązanie tego znacznika. Jest to ekscytujące, ponieważ sugeruje, że znacznik może działać w mózgach żywych pacjentów HD.
Testowanie znaczników huntingtyny u ludzi
Andrew Wood mówił następnie o kilku kolejnych innych ligandach obrazowania, które mogą pomóc nam mierzyć, jak toksyczne białko huntingtyna gromadzi się w mózgu. Jego zespół prowadzi badanie iMagemHTT, które jest badaniem klinicznym znacznika huntingtyny omówionego w poprzednim wystąpieniu. Wykonują jednoczesne pobieranie próbek krwi i obrazowanie PET/MRI, aby zrozumieć jak przenosi huntingtynę i w jaki sposób jest przetwarzany przez organizm.
Wood dokładnie zbadał u ludzi różne dawki dwóch znaczników huntingtyny oraz jak długo utrzymują się w ciele i mózgu. Następnie kontynuowali pracę nad jednym z nich, który wydawał się najlepszy i najbezpieczniejszy. Wood przedstawił wstępne dane od trzech uczestników fazy I badania klinicznego tego znacznika, w tym dane dotyczące bezpieczeństwa i jego rozkładu w czasie. Jak dotąd wszystko wygląda obiecująco, a kolejni uczestnicy będą włączani do badania.
Badanie będzie rozwijać się na przestrzeni przyszłego roku, a uczestnicy z HD lub bez HD będą otrzymywać znacznik oraz zostaną poddani obrazowaniu i badaniu krwi. Jeśli badanie się powiedzie, znacznik może zostać potencjalnie wykorzystany w przyszłych próbach do pomiaru obniżania poziomu huntingtyny w mózgu. Równolegle zespół Wooda we współpracy z CHDI pracuje również nad testowaniem właściwości kilku innych związków kwalifikujących się na znaczniki, jako rezerwowej opcji.
Ponieważ poziom huntingtyny w płynie mózgowo-rdzeniowym może nie odzwierciedlać poziomu huntingtyny w mózgu, znacznik taki jak ten ma niezwykły potencjał, jako przydatne narzędzie śledzenia progresji HD lub skuteczności terapii. Wood ma nadzieję, że najlepszy kandydat na znacznik trafi do klinik w 2022 roku.
Ocena biomarkerów HD w modelach HD u naczelnych innych niż ludzie
Jodi McBride omówiła następnie swoje badania nad biomarkerami w modelach choroby Huntingtona u naczelnych innych niż ludzie. Większość badań związanych z HD u naczelnych jest prowadzona na zdrowych małpach, aby zrozumieć, w jaki sposób leki mogą zostać dostarczone do dużego mózgu. McBride opracowała nowatorski model HD, w którym wirus dostarcza gen HD do mózgu, co prowadzi do nagromadzenia się zmutowanej huntingtyny u małp. Małpy te miały problemy z pamięcią roboczą i zadaniami ruchowymi, co jest nieco podobne do objawów HD, a także zmiany w mózgu podobne do zmian u ludzi z HD.
Zespół McBride kontynuuje badania nad metodami obrazowania i wizualizacji, w tym opisanymi przez Bertoglio i Wooda, aby potwierdzić, że te małpy HD będą użytecznym modelem do badania biomarkerów HD.
„Biomarkery to różne sposoby, dzięki którym naukowcy mogą dokładnie śledzić progresję HD i czy terapie obniżające poziom huntingtyny są skuteczne”
Innowacje w obrazowaniu mózgu w celu śledzenia progresji HD i definiowanie nowych biomarkerów
Derek Jones mówił następnie o nowych technologiach MRI (rezonansu magnetycznego) umożliwiających nieinwazyjne obrazowanie mózgu, które mogą być lepiej wykorzystane w celu śledzenia postępu HD i różnych biomarkerów choroby. Jones podsumował, że metody obrazowania stanowią nadzieję dla zrozumienia, jak działają choroby neurodegeneracyjne i w jaki sposób możemy je leczyć. Nawet w bardzo wczesnych badaniach MRI zmiany w strukturach mózgu HD były widoczne i dały nam wskazówki, w jaki sposób HD wpływa na pacjentów.
Jones podkreśla jednak, że interpretacja danych obrazowania i dokonywanie dobrych pomiarów stanowi duże wyzwanie. Wiele różnych zmian w mózgu może wyglądać tak samo, gdy patrzymy na dane MRI, więc rozróżnienie tych zmian jest bardzo ważne dla naukowców zajmujących się HD. Znacznie większe i dające większe możliwości urządzenia MRI pomogą łatwiej dostrzec te różnice i stają się coraz bardziej powszechne w szpitalach. Te nowe urządzenia pozwalają nam także dostrzec części mózgu, które wcześniej były trudne do zobrazowania, ale są ważne w chorobie- jak prążkowie, które jest ważnym regionem mózgu w HD.
Laboratorium Jonesa projektuje również nowe sposoby przeprowadzania eksperymentów w zakresie obrazowania mózgu, aby lekarze i klinicyści mogli uzyskać jak najwięcej informacji z badań MRI, widząc każdy możliwy szczegół struktury mózgu. Te nowe metody wymagają bardzo skomplikowanej matematyki! Mamy szczęście, że ci wybitni naukowcy pracują nad badaniami HD. Korzystając z tych najnowocześniejszych technik, laboratorium Jonesa jest w stanie zobaczyć bardzo subtelne różnice w strukturze mózgu osób z HD, które jeszcze nie wykazują objawów.
Następnie Jones przekazał podziękowania HDClarity, która standaryzuje kolekcję próbek płynu mózgowo- rdzeniowego (PMR) pacjentów HD z całego świata. Jones stosuje te same zasady technologii obrazowania w projekcie o nazwie ImageClarity.
Poszukiwanie nowych biomarkerów choroby Huntingtona w PMR
Końcowe przemówienie tego dnia wygłosił Niels Skotte, który opowiedział nam o swoich badaniach, w których śledzi poziomy różnych białek w płynie mózgowo- rdzeniowym i krwi ludzi z chorobą Huntingtona. Skotte poszukuje nowych biomarkerów, które mogą śledzić progresję HD u pacjentów.
Wykorzystując tylko niewielkie ilości krwi lub płynu mózgowo- rdzeniowego, Skotte i współpracownicy są w stanie zidentyfikować, jakie białka znajdują się w różnych próbkach od osób z HD, będących w bardzo różnych stadiach choroby. Skotte i współpracownicy odkryli znaczące zmiany białkowe zarówno w próbkach PMR, jak i krwi, gdy porównują próbki kontrolne, pacjentów HD z objawami i przedobjawowych nosicieli genu HD.
Skotte zaobserwował dobrą korelację białka o nazwie NfL, które zostało wcześniej zidentyfikowane; poziom NfL wzrasta wraz z postępem choroby u osób z HD. Jest to już stosowane jako biomarker w badaniach klinicznych HD. Poziom kolejnego białka o nazwie PENK, którym zajmuje się Skotte, zmniejsza się wraz z postępem choroby u ludzi z HD. Skotte i współpracownicy kontynuują ocenę tych nowych, potencjalnych biomarkerów, aby zwalidować zmiany ich poziomów w trakcie choroby.
Do następnego razu…
I to podsumowuje wystąpienia na dziś. Jutro wrócimy na ostatni dzień prezentacji.
Więcej informacji o naszej polityce ujawniania informacji znajdziesz w naszym FAQ…


