
Konferencja Terapeutyczna Choroby Huntingtona 2016 – dzień 1
Białka i DNA – Jeff i Ed relacjonują 1. dzień konferencji terapeutycznej choroby Huntingtona 2016

Mamy luty, a to oznacza, że czołowi światowi naukowcy ściągają do Palm Springs na doroczną konferencję terapeutyczną HD!
Poniedziałek rano – nowości z Fundacji CHDI
Przed oficjalnym rozpoczęciem spotkania, pracownicy Fundacji CHDI omawiają naukowe postępy.

Tom Vogt, wiceprezes CHDI, zapoznaje publiczność z wysiłkami CHDI mającymi na celu lepsze zrozumienie HD. Vogt przypomina ogromne badanie opublikowane w tym roku, w którym ujawniono geny modyfikujące wiek pojawienia się pierwszych objawów HD. Geny te mogą nam pomóc lepiej zrozumieć przebieg HD, jak również dostarczyć nowych celów dla leków. By móc dokonać takiego przełomu, zespół badawczy potrzebował próbek DNA dosłownie tysięcy ochotników – pacjentów HD.
Kolejne duże badanie, tym razem na myszach HD, dostarczyło ogromnych ilości danych na temat sposobu oddziaływania mutacji HD na różne tkanki. Co ważne, nowe ogromne zestawy danych zostały udostępnione on-line wszystkim naukowcom na całym świecie. Każdy naukowiec, który chce uzyskać dostęp do wyników obydwu badań, może znaleźć je tutaj: https://www.hdinhd.org/.
Celia Dominguez (wiceprezes ds. chemii w CHDI) prezentuje wysiłki fundacji na rzecz rozwoju leków. Badanie pacjentów HD i modeli zwierzęcych jest ważne, ale potrzeba chemików żeby przygotować lek, który będzie można przekazać chorym. Dominguez z zespołem zajmują się nie tylko eksperymentalnymi lekami, opracowują również inne związki chemiczne, które poszerzają zakres działań lekarzy i naukowców HD.
Zespół Dominguez szuka podobnych do leków substancji chemicznych, które obniżają poziom zmutowanego białka HD – przyczyny każdego przypadku choroby. Dominguez omawia starania CHDI w kwestii opracowania leków, które pomogą komórkom radzić sobie z uszkodzeniami DNA, które narastają w HD. Dane z badań na myszach sugerują, że modulowanie sposobu, w jaki komórki radzą sobie z uszkodzeniami ich DNA, może redukować objawy typowe dla choroby Huntingtona. Ale myszy nie są ludźmi, naukowcy opracowują nowe substancje lecznicze z nadzieją odtworzenia efektu obserwowanego u myszy.
Na koniec, Dominguez zdradza, że chemicy pracują nad substancją, która pozwoliłoby naukowcom zajrzeć do mózgów pacjentów z HD. Chodzi o znacznik chemiczny, który pozwoliłby naukowcom zmierzyć ilość szkodliwego białka HD w mózgach żywych pacjentów! Zespół Dominguez weryfikuje poprawność działania substancji na tkankach zwierzęcych i ludzkich. Wczesne badania są bardzo obiecujące, w niedługim czasie należy spodziewać się wczesnych prób klinicznych z udziałem pacjentów z chorobą Huntingtona.
Jeśli to zadziała u ludzi, zwiększy się szansa powodzenia prób klinicznych opartych na technikach wyciszania genów.
Prof Cristina Sampaio kompleksowo przedstawia programy kliniczne CHDI, w tym Enroll-HD, który zapewnia platformę dla badań. CHDI zależy na projektowaniu 'odpowiednio mocnych’ badań – to znaczy, prowadzonych z dużą liczbą uczestników, wystarczającą by odpowiedzieć na stawiane pytanie. CHDI chce również gromadzić dane, żeby mogła z nich korzystać cała społeczność HD.
Wtorek rano – białko huntingtyna
Konferencja terapeutyczna HD 2016 rozpoczyna się od sesji skoncentrowanej na huntingtynie – białku, będącym produktem genu HD. Profesor Elena Cattaneo przypomina zebranym, że gen HD to antyk – po raz pierwszy pojawił się ponad 800 milionów lat temu! O ile tylko ludzie chorują na Huntingtona, to gen można znaleźć u jeżowców i śluzowców. Trudno go badać, po części dlatego, że jest około 10 razy większy od przeciętnego ludzkiego genu.
Komórki wykorzystują geny jako receptury do konstruowania 'białek’, które działają w komórkach. Mamy więc gen HD, a także białko HD (huntingtynę). Jest prawdopodobne, że uszkodzenia komórek mózgu, które powodują HD, są rezultatem negatywnego oddziaływania białka, a nie samego genu.
„Uszkodzone DNA musi zostać naprawione, ale wydaje się, że ten normalny proces przebiega niewłaściwie w przypadku rozszerzenia CAG w genie HD.”
Poranna sesja koncentruje się na lepszym zrozumieniu tego starego, dużego i ważnego białka. Lepsze zrozumienie białka, które powoduje HD, może nam pomóc zaprojektować w przyszłości lepsze terapie na HD.
Ralf Langen, USC, usiłuje zrobić zdjęcie białka HD przy użyciu zaawansowanych technik obrazowania. Zespół Langena pracuje na oczyszczonych fragmentach białka HD i używając zaawansowanych narzędzi może wnioskować o jego kształcie. Białka wykonują swoje funkcje w komórkach właśnie dzięki niepowtarzalnym kształtom. Prace takie jak Langena, mają kluczowe znaczenie dla zrozumienia tego, co robi białko HD. Co być może ważniejsze, Langen próbuje zrozumieć, w jaki sposób mutacja HD zmienia strukturę białka HD. Jedną z dziwnych rzeczy na temat białka HD jest to, że zmutowane białko tworzy wewnątrz komórek grudki. Niektórzy naukowcy uważają, że to właśnie te grudki, a nie pojedyncze białka HD, mogą powodować problemy komórek mózgowych. Kolejnym zadaniem w laboratorium Langena jest zrozumienie tego, jak zmienia się kształt pojedynczego białka HD w czasie formowania grudki.
Hilal Lashuel to kolejny badacz usiłujący zrozumieć kształt białka HD. Lashuel jest szczególnie zainteresowany zrozumieniem wpływu „modyfikacji post-translacyjnych” na kształt białka HD (!). Białka, po utworzeniu w komórce, są dekorowane różnymi znacznikami chemicznymi, które zmieniają ich kształt. Ponieważ w przypadku białek kształt determinuje funkcje, te małe znaczniki dostrajają funkcje białka w komórce. Dlaczego dbamy o chemiczne znaczniki białka HD? Z badań na myszach wiemy, że konkretne znaczniki czynią białko HD mniej toksycznym. Zespół Lashuel opracował technikę chemicznej syntezy dużych ilości białka HD z dowolnym znacznikiem chemicznym. Dzięki temu, naukowcy mogą badać wpływ dowolnej kombinacji znaczników na kształt i funkcje białka HD.
Długoletni badacz HD Scott Zeitlin również stara się zrozumieć zmutowany w chorobie Huntingtona fragment białka HD. Zeitlin wykorzystuje myszy, u których małe fragmenty genu HD zostały usunięte. Najprostszym sposobem zbadania co robi fragment DNA jest przerwanie go i obserwacja co się stanie! Co ciekawe, Zeitlin stwierdził, że może usunąć ważne obszary genu HD bez większego wpływu na mysz. Obecnie Zeitlin stara się zrozumieć, czy usunięcie ważnych fragmentów genu HD nasili u myszy objawy podobne do HD.
Fred Saudou z INSERM mówi o swojej pracy nad tym, co faktycznie białko huntingtyny robi w komórkach – to wciąż po części tajemnica. Dominująca teoria głosi, że mutacja powoduje, iż białko 'zyskuje’ zachowania lub funkcje toksyczne dla neuronów. Saudou: huntingtyna jest dużym białkiem z regionami podobnymi do sprężyny, które wyglądem mogą przypominać kilka sprężyn splecionych razem. Dobrze poznanym działaniem huntingtyny jest pomoc substancjom chemicznym w przemieszczaniu się wewnątrz neuronów. Huntingtyna pomaga w dostarczaniu z powierzchni do głębokich struktur mózgu użytecznej substancji chemicznej o nazwie BDNF. BDNF jest niezbędny do utrzymania komórek prążkowia w zdrowiu, jednakże w HD dostarczanie BDNF jest ograniczone, a komórki w prążkowiu obumierają. Saudou: Niepowodzenie dostawy BDNF w HD może być efektem tego, że zmutowane białko nie może dostarczać energii do molekularnych silników komórki. Aby ustalić, co się dzieje, kiedy białko huntingtyny jest cięte w różnych miejscach, Saudou wykorzystał enzym tnący białka (zapożyczony od wirusa). Co ciekawe, Saudou uznał, że konieczne były dwa cięcia (nie jedno), aby zmutowane białko huntingtyny stało się toksyczne dla komórek.
To ciekawe – wcześniej sądzono, że wystarczało tylko jedno cięcie wykonywane przez komórkowe enzymy tnące we właściwym miejscu. Saudou ustalił, że koniec ogona białka – 'koniec C’ był ważniejszy niż wcześniej sądzono. Wydaje się, że pewne fragmenty C-końca same w sobie są trujące, nawet jeśli białko nie ma zmutowanej postaci. Interesujące! Lecz nie zmutowane białko nie jest trujące, musi zatem istnieć jakieś wzajemne oddziaływanie pomiędzy końcem C i fragmentem zmienionym przez mutację. Saudou stwierdził, że C-końcowy fragment huntingtyny oddziałuje z innym białkiem zwanym dynamina 1, które jest istotne dla transportu. Saudou kontynuuje rozpoczęte prace w tej dziedzinie.
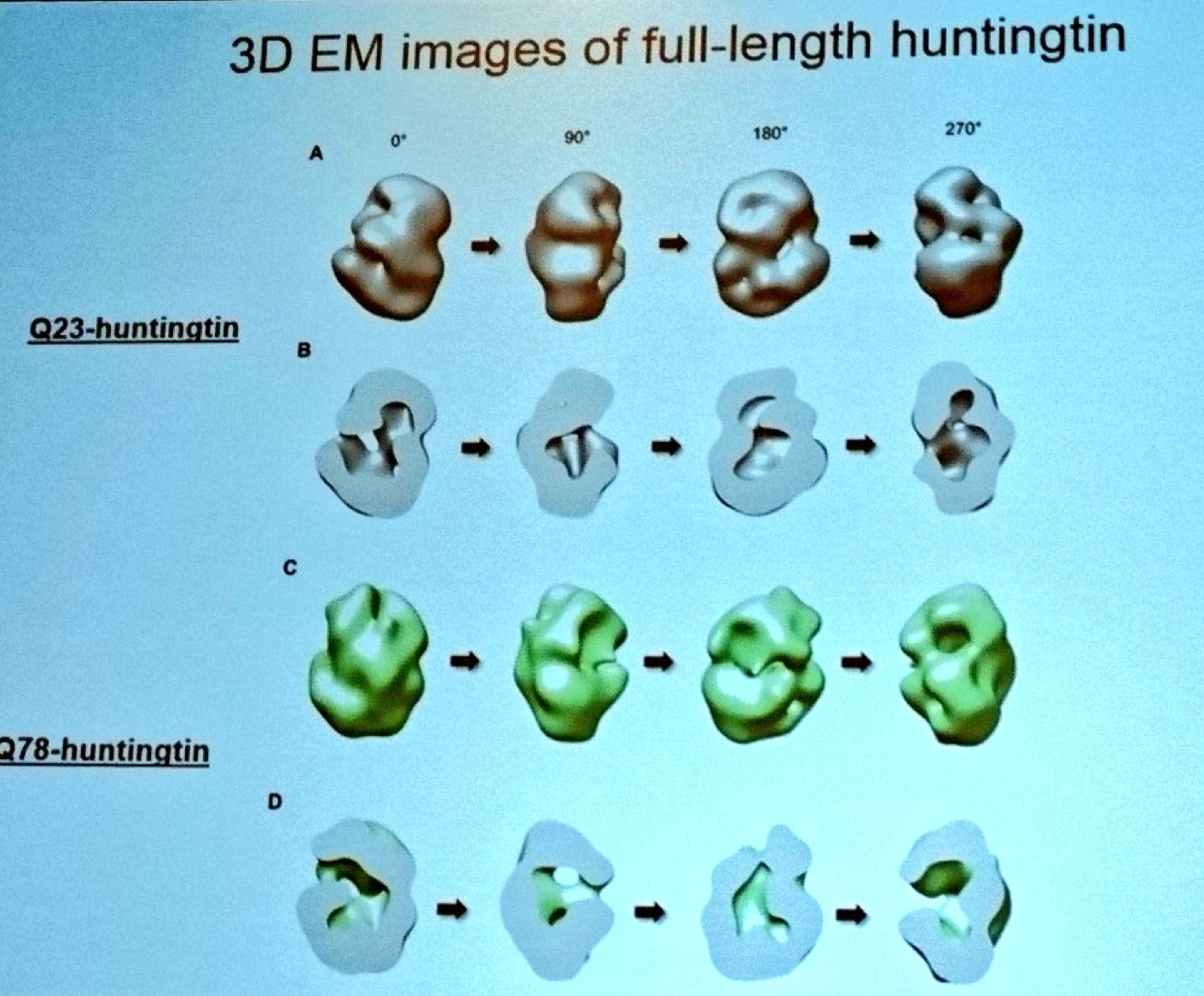
Kolejną prezentację wygłasza Ihn Sik Seong z Massachusetts General Hospital. Seong opracował techniki oczyszczania całego białka huntingtyny, dzięki którym może badać jego strukturę. Wykorzystując potężny mikroskop elektronowy Seong opracował model wyglądu białka huntingtyny. Seong pracuje zarówno na normalnej jak i zmutowanej huntingtynie, dlatego też może prześledzić jak zmienia się ogólny kształt białka na skutek mutacji. Modele Seong sugerują, że białko huntingtyny tworzy pusty wewnątrz kształt, podobny do piłki tenisowej. Wracając do początku, Seong stara się zrozumieć, jak chemiczne znakowanie (modyfikacja post-translacyjna) zmienia huntingtynę.
Świetna sesja! Cała wiedza o tym, jak mutacja HD wpływa na strukturę huntingtyny, niemal prowokuje kolejną falę odkryć!
Wtorek po południu – DNA i RNA
Tego popołudnia będziemy kontynuować nauki podstawowe, ale przechodzimy z poziomu białek do poziomu DNA. Bądźcie czujni!
Steve Horvath, UCLA, jest zainteresowany zmianami chemicznymi w DNA, które zachodzą w procesie starzenia. Jedna z tych zmian jest tak powtarzalna, że Horvath wykazał, że może być wykorzystywana jako zegar do prognozowania wieku komórki. Stosując ten genetyczny zegar, Horvath stwierdził, że różne części ciała „starzeją się” w różnym tempie. Zatem co z próbkami mózgu od osób z chorobami mózgu, takimi jak HD? Czy mózgi pacjentów z HD starzeją się szybciej niż ludzi niemających HD? Tak – wykorzystując swoją nową metodę zegara genetycznego Horvath stwierdził, że mózgi HD wyglądają starzej niż powinny.
Karine Merienne zajmuje się procesem zwanym „transkrypcją”, jest to proces, w którym komórki określają jakie geny muszą wytwarzać. Każda komórka organizmu posiada kopię każdego z około 25000 genów odziedziczonych od mamy i taty. Komórki mózgowe potrzebują genów mózgowych, a komórki skóry muszą wykorzystywać geny skóry. „Transkrypcja” to proces włączania odpowiednich genów. W mózgach pacjentów z HD wzór aktywacji genów jest zmieniony, Merienne przy pomocy myszy HD usiłuje zrozumieć dlaczego. Merienne znalazła szczególny proces, który wydaje się przebiegać nieprawidłowo w komórkach HD, co może pomóc wyjaśnić niektóre zmiany w transkrypcji. Eksperymentalny lek, który poprawia ten konkretny proces transkrypcyjny, wydaje się chronić wydajność pamięci u myszy HD.
Vanessa Wheeler bada, w jaki sposób mutacja powodująca HD nasila się w czasie w określonych tkankach. Każda osoba z HD odziedziczyła konkretną zmianę w DNA, ekspansję sekwencji DNA „C-A-G” w genie HD. U pacjentów z HD, powtórzeń CAG jest zawsze więcej niż normalnie – więcej niż 36. Ogólnie rzecz biorąc, większa ilość powtórzeń CAG ma związek z pojawieniem się objawów HD w młodym wieku, choć nie ma w tej materii jednej reguły. Laboratorium Wheeler jest zainteresowane dziwnym zjawiskiem – w niektórych tkankach, łańcuch powtórzeń CAG wydłuża się z wiekiem. Prążkowie, część mózgu najbardziej dotknięta w HD, jest tą częścią ciała, w której ekspansja CAG zdarza się najczęściej.
Wheeler chciałaby zrozumieć, dlaczego ilość powtórzeń CAG w niektórych częściach ciała ma tendencję do wzrastania w czasie. Zespół Wheeler wykazał, że proces zwany naprawą DNA powoduje ekspansję regionu powtórzeń CAG w genie HD. Uszkodzone DNA musi zostać naprawione, ale wydaje się, że ten normalny proces przebiega niewłaściwie w przypadku rozszerzenia CAG w genie HD. Niedawne badanie przeprowadzone wśród pacjentów HD sugeruje, że zmieniona reakcja na uszkodzenia DNA może pomóc wyjaśnić różnice wieku wystąpienia pierwszych objawów HD. Wheeler prowadzi rozległe doświadczenia na myszach nowego typu, które opracowała, aby lepiej zrozumieć przebieg procesu „ekspansji CAG”.
Laura Ranum z University of Florida mówi o nowej, kontrowersyjnej idei. Pomyśl o słowie CART. Jeśli masz odczytać 3 litery od początku, otrzymasz CAR. Ale jeśli odczytasz 3 litery zaczynając od 2, otrzymasz ART. Coś podobnego może się dziać, gdy komórki odczytują DNA. Przez większość czasu odczytywanie rozpoczyna się od początku, ale czasami zdarza się poślizg i DNA jest odczytywane w niewłaściwej sekwencji, co skutkuje niespodziewanymi wiadomościami RNA czy białkami. Czasami DNA bywa nawet czytane wspak, co skutkuje dziwnymi 'ukrytymi’ wiadomościami RNA lub białkami. Ranum odkryła ten dziwny mechanizm odczytu DNA i nazywała go transkrypcją RAN (nieprzypadkowo brzmi jak początek jej nazwiska!).
W przypadku HD wiemy, że czytanie DNA w NORMALNY sposób prowadzi do powstania zmutowanego białka huntingtyny, wiemy również, że jest ono szkodliwe dla neuronów. Powstaje pytanie: czy zmutowana huntingtyna jest jedynie toksycznym produktem rozszerzonego genu czy na skutek dziwnego czytania DNA transkrypcja RNA wydziela toksyczne RNA lub inne szkodliwe białka. Zespół Ranum przyglądał się próbkom mózgu pochodzącym od zmarłych pacjentów HD i stwierdził obecność niektórych z dziwnych białek w pewnych obszarach. Znalezienie białek RAN w mózgu to dopiero początek, ale nie musi oznaczać, że są szkodliwe. Na komórkach hodowanych w laboratorium Ranum wykazała, że pewne białka RAN mogą być szkodliwe, jednakże niekoniecznie przekłada się na całe mózgi.
Ray Truant (McMaster University) pracuje nad zrozumieniem tego, co normalnie robi białko huntingtyny oraz jak wpływa na to mutacja powodująca HD. Podobnie jak wielu mówców dzisiejszego poranka, Truant jest szczególnie zainteresowany małymi znacznikami chemicznymi, zdobiącymi huntingtynę. Truant używa zrobotyzowanych mikroskopów i zaawansowanego oprogramowania do automatycznego analizowania skutków leków na komórki HD. Tymi technikami Truant śledzi białko huntingtyny w obrębie komórek narażonych na różne rodzaje stresu. Truant odkrył, że związek chemiczny zwany kinetyną pomaga utrzymać zmutowane komórki HD w zdrowiu.
Gdy myszom HD podawano kinetynę, niektóre objawy podobne do HD uległy złagodzeniu, co wspiera ideę, że cząsteczka ta może być pomocna. Laboratorium Truant’a przeprowadziło również rozległe eksperymenty, które sugerują, że białko huntingtyny może być zaangażowane w uszkadzanie DNA. Stawia hipotezę, że w sytuacji uszkodzenia DNA kinetyna pomaga zmutowanemu białku huntingtyny lepiej wykonać swoją pracę. Truant odnosi się niektórych dzisiejszych wystąpień – sugeruje, że białko huntingtyny może odgrywać pewną rolę w uszkadzaniu DNA. Truant proponuje badania kinetyny jako potencjalnej terapii na HD.
Więcej informacji o naszej polityce ujawniania informacji znajdziesz w naszym FAQ…


