Wyciszanie genów ASO sięga dalej i trwa dłużej
Wyciszanie genu huntingtyny za pomocą leków ASO sięga dalej, trwa dłużej i jest bezpieczne. Wkrótce badania na ludziach?
Leki nazywane antysensownymi oligonukleotydami, czyli ASO, to jeden ze sposobów wyciszania genu, który powoduje chorobę Huntingtona. Nowa publikacja w czasopiśmie Neuron sugeruje, że wyciszanie genów ASO sięga dalej w mózgu niż inne metody, trwa dłużej i jest bezpieczne.
Z niecierpliwością czekaliśmy na rozwój w dziedzinie wyciszania genów, więc byliśmy bardzo podekscytowani, czytając ważne nowe badanie opublikowane dzisiaj w czołowym czasopiśmie Neuron. Grupa badaczy, kierowana przez dr Dona Clevelanda z University of California San Diego, we współpracy z firmami farmaceutycznymi Isis pharmaceuticals, Genzyme i Novartis, opracowywała
Podsumowanie genetyki

Źródło obrazu: www.biocomicals.com autorstwa Alpera Uzuna, PhD
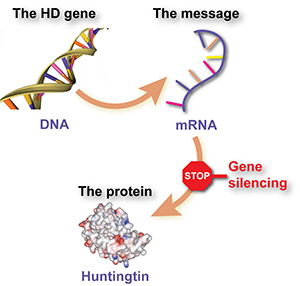
Gen choroby Huntingtona to tylko jeden z około 25 000 par genów, składających się z DNA, które niosą kod do wytwarzania białek; elementów budulcowych komórek, z których składają się nasze ciała. Między kodem DNA a gotowym białkiem jest kilka etapów. Jeden z tych etapów obejmuje RNA posłańcowe, czyli mRNA.
Gen HD to kod, który po przetłumaczeniu tworzy mRNA HD. To mRNA mówi komórce, jak wytwarzać białko huntingtyny. Ludzie, którzy mają chorobę Huntingtona, mają jedną normalną kopię i jedną rozszerzoną kopię genu, więc wytwarzają też dwa różne typy mRNA.
Od czasu zidentyfikowania genu HD, prawie 20 lat temu, naukowcy próbują zrozumieć, co robi, jak powoduje objawy HD i jak skutecznie go wyłączyć.
Wyłączanie genu
Istnieje kilka możliwych metod wyłączania genu HD. Prawdopodobnie najbardziej znaną jest interferencja RNA, znana również jako RNAi lub czasami siRNA.
Inne podejście wykorzystuje nieco inną cząsteczkę nazywaną antysensownymi oligonukleotydami, czyli ASO.
ASO to trochę jak krzyżówka między DNA a mRNA. Są chemicznie podobne do DNA, ale składają się z pojedynczej nici jak mRNA. Tak jak inne leki wyciszające geny, są zaprojektowane, żeby przyłączyć się do mRNA HD i kazać komórce je zniszczyć, zapobiegając w ten sposób wytwarzaniu nieprawidłowego białka huntingtyny.
Teoria stojąca za tym jest taka, że jeśli zapobiegasz wytwarzaniu nieprawidłowego białka huntingtyny, zapobiegasz jego szkodliwym skutkom na komórki, a tym samym zmniejszasz lub opóźniasz objawy.
W ciągu ostatnich kilku miesięcy słyszeliśmy dobre wiadomości od kilku grup pracujących nad lekami RNAi, ale do niedawna badacze ASO nie publikowali tak dużo. To właśnie się zmieniło dzięki tej najnowszej publikacji, która przybliża nas do kilku lat ciężkiej pracy.
Badania kliniczne ASO na ludziach w innych chorobach neurologicznych już się rozpoczęły, ale sytuacja w HD została spowolniona przez niektóre nierozstrzygnięte pytania.
Działanie ASO
W tej zupełnie nowej pracy sprytna grupa badaczy przyjrzała się skutkom stosowania ASO w 3 różnych modelach myszy HD, a także w modelu małpy (najlepszej rzeczy po ludziach pod względem modeli zwierzęcych), żeby spróbować znaleźć odpowiedzi na kilka różnych pytań.
„ASO leczą części mózgu, do których inne techniki wyciszania genów nie były w stanie dotrzeć”
U małp lek był wstrzykiwany do płynu rdzeniowego – procedura znacznie mniej inwazyjna niż wstrzykiwanie go do mózgu i taka, która byłaby preferowana dla pacjentów ludzkich.
1. Co się dzieje, gdy podajesz ASO i jak długo to trwa?
Cóż, podawali ASO do komór mózgu (wypełnionych płynem przestrzeni w mózgu) przez dwa do trzech tygodni. To doprowadziło do zmniejszenia poziomów nieprawidłowego białka huntingtyny w wielu obszarach znanych jako ważne w mózgu, włączając prążkowie, które jest najbardziej wyraźnie dotknięte w chorobie Huntingtona. ASO były w stanie rozprzestrzenić się znacznie dalej w mózgu niż widzieliśmy to z lekami RNAi.
Co więcej, poziomy pozostawały niskie przez długi czas – do trzech miesięcy po zatrzymaniu infuzji.
2. Co stało się z objawami?
Badacze są w stanie monitorować objawy modeli zwierzęcych za pomocą testów, które mierzą ruchy i zachowanie. Zwierzęta leczone ASO poprawiły się w porównaniu z ich nieleczonymi odpowiednikami. Co jeszcze lepsze, poprawa utrzymywała się przez długi czas – i nie tylko wtedy, gdy poziomy białka pozostawały niskie. Objawy były nadal lepsze kilka miesięcy po tym, jak poziomy nieprawidłowego białka huntingtyny wróciły do poziomów sprzed leczenia.
Potwierdza to teorię, że mózg może potrzebować tylko niewielkiej pomocy, aby przetrwać skutki działania genu HD. Jeden z wybitnych badaczy HD, Carl Johnson, ukuł termin ’wakacje od huntingtyny’, sugerując, że krótka przerwa od szkodliwego białka może być wszystkim, czego potrzeba, aby przechylić szalę na korzyść wyzdrowienia.
3. Kiedy jest najlepszy czas na podanie leczenia?
To badanie sugeruje, że wczesne leczenie jest prawdopodobnie lepsze.
Objawy motoryczne w jednym konkretnym modelu myszy poprawiły się w ciągu miesiąca od leczenia i nadal się poprawiały, aż myszy HD nie różniły się od normalnych myszy. Objawy behawioralne zostały przywrócone do normy w ciągu 2 miesięcy od leczenia.
Gdy leczone były starsze myszy z większą liczbą objawów, ich objawy motoryczne i behawioralne rzeczywiście się poprawiły, ale zajęło znacznie więcej czasu, zanim poprawy stały się zauważalne, i nie odzyskały tak dużo jak młodsze, zdrowsze myszy.
4. Co się dzieje, jeśli zablokujesz 'normalne’ mRNA HD?
To jedno z głównych pytań, które nas powstrzymuje od rozpoczęcia badań w chorobie Huntingtona. Wiemy, że białko huntingtyny jest niezbędne do wczesnego rozwoju, ponieważ embriony myszy zaprojektowane tak, żeby nie produkować huntingtyny, umierają przed urodzeniem. Czy bezpieczne jest wyłączenie produkcji zarówno normalnego, jak i nieprawidłowego białka huntingtyny u dorosłych?
Dzięki tej pracy i pracy innych badaczy wyciszania genów zbliżamy się do odpowiedzi. Wyłączenie normalnego mRNA HD na okres do 3 miesięcy u zdrowych małp było dobrze tolerowane. W modelach zwierzęcych HD wyłączenie zarówno normalnego, jak i nieprawidłowego mRNA nie zmieniło ilości wyzdrowienia i nie miało żadnych złych skutków.
Jedynym możliwym problemem teraz jest to, że ludzie mogą być bardziej wrażliwi na mniejszą ilość huntingtyny niż jakiekolwiek zwierzę, na którym moglibyśmy testować leki. Tylko badanie z pacjentami powie nam na pewno.
To wszystko to dobre wiadomości
Mamy teraz dowód, że ASO leczą części mózgu, do których inne techniki wyciszania genów nie były w stanie dotrzeć. Nie tylko to, ale krótkoterminowa infuzja z ASO wystarczyła, żeby opóźnić progresję objawów w modelach zwierzęcych choroby Huntingtona. A odwrócenie objawów trwa znacznie dłużej niż oczekiwano, nawet po tym, jak poziomy nieprawidłowego białka huntingtyny wracają do normy.
Co dalej?
Wiemy, że ludzie, którzy niosą rozszerzony gen HD, mogą pozostać całkowicie zdrowi przez wiele lat, mimo produkowania nieprawidłowego białka huntingtyny od urodzenia.
Być może jednorazowe leczenie ASO lub leczenie raz w roku wystarczy, aby 'zresetować zegar choroby’ poprzez zablokowanie produkcji białka huntingtyny na wystarczająco długi czas, aby komórki mogły oczyścić się z nagromadzenia. Następnym etapem badań tej grupy będzie sprawdzenie, jak długo utrzymuje się działanie pojedynczego wstrzyknięcia ASO.
Ta praca sugeruje również, że infuzja do płynu rdzeniowego może być wystarczająco dobra dla leków ASO. To nie jest spacer po parku, ale jest stosunkowo proste w porównaniu z montowaniem rurek i pomp, żeby dostarczać leki bezpośrednio do mózgu.
Musimy też ustalić, ile ASO będzie potrzebne, żeby wywołać efekt u ludzi, kiedy i jak długo powinno być podawane, i być przygotowanymi na nieoczekiwane skutki uboczne.
Ale wydaje się, że zbliżamy się coraz bardziej do ludzkich badań wyciszania genów HD. A z kilkoma różnymi grupami na skraju badań i chętnymi do bycia pierwszymi do testowania swojego leku u pacjentów, to naprawdę ekscytujący czas dla wyciszania genów w HD.
Dowiedz się więcej
Źródła i odnośniki
Więcej informacji o naszej polityce ujawniania informacji znajdziesz w naszym FAQ…