
Konferencja terapii choroby Huntingtona 2018 – dzień 3
Aktualizacje z dnia 3 Konferencji Terapii Choroby Huntingtona: białko huntingtyny – i jego obniżanie

Dzień dobry z ostatniego dnia Konferencji Terapii HD 2018! Dzisiaj dwie sesje, pierwsza skupiona na białku wytwarzanym z genu HD. Druga zawiera aktualizacje dotyczące Badań Obniżania Huntingtyny zarówno od Wave Life Sciences, jak i Ionis Pharmaceuticals.
Czwartek rano – białko huntingtyny
Każdy pacjent z HD odziedziczył tę samą mutację – wydłużenie sekwencji C-A-G. Ta ekspansja występuje w genie, który teraz nazywamy genem HD. Geny są używane przez komórki jako instrukcje do wytwarzania białek – pierwsza sesja dzisiaj skupia się na białku HD.

Sandrine Humbert z Universite Grenoble Alpes od dawna interesuje się rozwojem mózgu i tym, jak gen i białko HD wpływają na ten proces. Aby zrozumieć ten proces, laboratorium Humbert stworzyło mysz, której brakowało genu i białka HD w mózgu. Odkryli, że komórki pozbawione genu HD dzieliły się i przemieszczały w nieprawidłowy sposób. Podczas rozwoju mózgu nowo narodzone komórki przemieszczają się do właściwego miejsca, często wspinając się po 'linach’ utworzonych przez inne komórki. Proces ten ulega zmianie, gdy gen HD zostaje usunięty, co sugeruje jego istotną rolę w tym procesie.
Andrea Caricasole z IRBM Science Park prowadzi zakrojone na szeroką skalę badanie „modyfikacji potranslacyjnych” białka huntingtyny. Odnosi się to do drobnych chemicznych „dekoracji” białka huntingtyny. Te dekoracje pozwalają komórkom dostosowywać funkcję białek. Białko huntingtyny ma prawdopodobnie dziesiątki takich znaczników, które są dodawane i usuwane, modyfikując funkcję huntingtyny w odpowiedzi na szereg sygnałów. Wiele z tych dekoracji ma intrygujący wpływ na białko huntingtyny i może nawet zapobiegać uszkadzaniu komórek przez zmutowane białko huntingtyny. Pisaliśmy o tym wcześniej na HDBuzz. Zespół Caricasole opracowuje bardzo czułe testy dla poszczególnych dekoracji białka huntingtyny. Pozwalają one śledzić, które z nich zmieniają się w przebiegu choroby i być może szukać sposobów na ich naprawę.
Rohit Pappu z Washington University stosuje bardzo ukierunkowane podejście do zrozumienia białka huntingtyny. Jego laboratorium opracowuje narzędzia do badania tej części białka, której kształt jest zależny od mutacji HD. Laboratorium Pappu wykorzystuje ogromną moc obliczeniową, aby przewidzieć kształt części białka huntingtyny zmienionej przez mutację. Techniki te pozwalają zaobserwować kształt „kijanki”. Kształt tej kijanki był przedmiotem intensywnej debaty w środowisku HD! Techniki Pappu zdecydowanie popierają jedną stronę tej debaty, co z pewnością pomoże nam lepiej zrozumieć tę kluczową część białka huntingtyny.
Xaio-Joang Li z Emory University opracował interesujący model mysi, w którym gen huntingtyny może być wyłączany u dorosłych myszy, w mózgu, ciele lub obu miejscach. Te myszy nie mają rozszerzonych genów huntingtyny – pomagają nam jedynie zrozumieć, czy wyłączenie 'zdrowej’ wersji genu ma konsekwencje. Co uspokajające, gdy gen jest wyłączony, nic złego nie dzieje się w mózgu. Nieoczekiwanie, wyłączenie genu wywołało stan zapalny trzustki. Nie jest jasne, co to może oznaczać dla pacjentów, ale obecne terapie obniżające poziom huntingtyny nie powinny znacząco zmniejszać jej poziomu w organizmie – tylko w mózgu. Li wykorzystał również edycję genomu CRISPR-Cas9 do usunięcia szkodliwej części genu HD u myszy. Dezaktywacja zmutowanego genu u myszy skutecznie zmniejszyła tworzenie się toksycznego białka huntingtyny, a myszy lepiej się poruszały. Dr Li był bardzo zajęty! Stworzył również model świni z chorobą Huntingtona używając edycji genomu CRISPR. Może to być przydatne do testowania nowych leków, ponieważ mózg świni jest podobny do ludzkiego.
„Kochanek zamroził białko i użył wiązki elektronów do zrobienia tysięcy zdjęć. Zostały one następnie połączone przez komputer, aby stworzyć pierwsze w historii obrazy szczegółowej struktury molekularnej białka huntingtyny.”
Ankur Jain z @UCSanDiego bada RNA – „cząsteczki przekaźnikowe” powstające, gdy komórka chce wykorzystać instrukcje zawarte w DNA do wytworzenia białka. Nasze DNA znajduje się w jądrze komórkowym, ale RNA swobodnie unosi się w całej komórce. Tradycyjny sposób myślenia o wielu genetycznych chorobach mózgu zakłada, że są one powodowane przez toksyczne białka, ale coraz więcej dowodów wskazuje, że czasami cząsteczki RNA wytwarzane ze zmutowanych genów również mogą być toksyczne. Na przykład, niektóre sekwencje RNA mogą przyklejać się do ważnych maszynerii białkowych i uniemożliwiać im wykonywanie ich funkcji w komórce. Jednym z możliwych oznak toksycznego RNA jest tworzenie się nieprawidłowych skupisk RNA widocznych w komórkach w HD i innych chorobach mózgu. Jain odkrył, że może tworzyć sztuczne skupiska RNA poprzez podgrzewanie i chłodzenie go jak galaretki. Te skupiska tworzą się tylko wtedy, gdy RNA zawiera lepkie sekwencje, takie jak te z odcinka CAG w HD. Nie jest jasne, czy te skupiska RNA powodują szkody w HD, ale mogą. Na przykład, jeśli RNA jest uwięzione w jądrze, nie może być wykorzystane do wytwarzania białek. Cząsteczki antysensowne (podobne do tych obecnie testowanych w badaniach klinicznych HD) mogą przyłączać się do RNA w jądrze i zapobiegać tworzeniu się skupisk. Inne leki teoretycznie również mogłyby być wykorzystane do rozwiązania problemu lepkości RNA w chorobach mózgu.
Teraz ekscytujący, przełomowy wykład Stefana Kochanka, którego laboratorium właśnie odkryło strukturę białka huntingtyny! Poznanie wyglądu białek jest naprawdę ważnym krokiem w zrozumieniu, jak działają i jak można to zmienić za pomocą leków. Gen huntingtyny został odkryty 25 lat temu, ale białko jest duże, chwiejne i lepkie, co bardzo utrudniało odkrycie jego struktury. Jeden zespół wysłał nawet białko w kosmos, próbując uzyskać kryształy, ale niestety bez powodzenia. Zespołowi Kochanka udało się tam, gdzie inni zawiedli, a ich wyniki zostały właśnie opublikowane w Nature. Przełomem było ustabilizowanie huntingtyny za pomocą innego białka zwanego HAP40 („białko związane z huntingtyną 40”). Po ustabilizowaniu z HAP40, Kochanek zamroził białko i użył wiązki elektronów do zrobienia tysięcy zdjęć. Zostały one następnie połączone przez komputer, aby stworzyć pierwsze w historii obrazy szczegółowej struktury molekularnej białka huntingtyny. To naprawdę świetne i daje nam mnóstwo materiału do pracy. Jedno zastrzeżenie: niektóre obszary były wciąż zbyt chwiejne, aby określić ich strukturę – w tym najważniejsza część na początku białka, która zawiera mutację.
Czwartek po południu – obniżanie huntingtyny
Wielki koniec dnia i konferencji, gdy rozpoczyna się sesja o terapiach obniżających poziom huntingtyny. Obniżanie poziomu huntingtyny odnosi się do podejść mających na celu zmniejszenie poziomu białka huntingtyny. Jest wiele sposobów, aby to zrobić, ale wiele z nich celuje w „RNA”, które jest pośrednikiem między informacją w genie HD a białkiem huntingtyny.
Michael Rape z UC Berkeley interesuje się oszukiwaniem komórek, aby niszczyły poszczególne białka w komórce. W wielu przypadkach, w tym HD, byłoby naprawdę pomocne selektywne usunięcie jednego konkretnego białka. Komórki mają więcej niż jeden szlak degradacji białek – ważny z nich wykorzystuje maleńką chemiczną dekorację zwaną „ubikwityną” jako znacznik. Komórki rozpoznają ubikwitynę jako swego rodzaju sygnał „zjedz mnie” i rozkładają białka je noszące. Laboratorium Rape’a było zaangażowane w zrozumienie, jak komórki wykorzystują znaczniki ubikwityny do oznaczania białek, które muszą zostać zniszczone bardzo szybko – na przykład tych, które mogą być toksyczne. Laboratorium Rape’a zbudowało narzędzia, które po raz pierwszy pozwalają naukowcom obserwować białka przechodzące przez ten szybki szlak destrukcji. Maszyneria do szybkiej destrukcji białek jest potężnym narzędziem – jednym, które laboratorium Rape’a jest zainteresowane wykorzystaniem. Niedawno opracowana technika – zwana „PROTAC” – pozwala naukowcom wykorzystać system ubikwityny do zmuszenia komórek do niszczenia konkretnych białek.
Scott Zeitlin (University of Virginia) pracuje z myszami HD, aby ustalić, co się dzieje, gdy obniżamy poziom zmutowanej huntingtyny, normalnej huntingtyny lub obu. Należy pamiętać, że każda osoba dziedziczy jedną huntingtynę od każdego rodzica – a większość osób z HD ma jedną normalną i jedną zmutowaną kopię. Naukowcy nazywają zdrowe/normalne białko „dzikim typem”, ponieważ jest to wersja częściej występująca w naturze. Te pytania są ważne, ponieważ wszystkie terapie obniżające poziom huntingtyny mają na celu zmniejszenie ogólnej ilości białka huntingtyny w mózgu. Niektóre, jak lek Ionis, zmniejszają poziom obu wersji białka równomiernie. Inne, jak leki Wave, starają się obniżyć poziom zmutowanego białka bardziej niż dzikiego typu. Uważamy, że prawdopodobnie obniżenie poziomu zmutowanego białka samodzielnie lub równolegle z dzikim typem będzie korzystne – ale wciąż pozostaje otwarte pytanie, czy obniżanie poziomu huntingtyny jest bezpieczne. Zeitlin wyhodował myszy, u których produkcja zmutowanego białka, dzikiego typu lub obu może być zmniejszona po pełnym wyrośnięciu myszy. Zeitlin odkrył, że wczesne obniżenie poziomu zmutowanej huntingtyny miało większy wpływ na gromadzenie się białka w mózgu. Podobnie, wczesna redukcja zmutowanej huntingtyny przyniosła większe korzyści w zakresie utraty wagi i umiejętności ruchowych u myszy. To samo dotyczyło zmniejszenia produkcji obu wersji białka – wczesne leczenie przyniosło większe korzyści. Podsumowując: im wcześniej, tym lepiej, jeśli chodzi o hamowanie huntingtyny. W jednym teście (siła chwytu) obniżenie tylko zmutowanego białka poprawiło wyniki, ale hamowanie obu wersji nie. Poza tym oba podejścia były mniej więcej tak samo skuteczne, a kluczowym czynnikiem było to, jak wcześnie rozpoczęto leczenie. Zeitlin zbadał również, co się dzieje, jeśli pozwoli się huntingtynie wrócić do poprzedniego poziomu, i to było złe dla myszy. To sugeruje, że długoterminowe leczenie jest lepsze niż krótkoterminowe – dokładnie tego można się było spodziewać.
Jodi McBride z OHSU opisuje swoją pracę wykorzystującą nieszkodliwe wirusy do dostarczania instrukcji do komórek mózgowych, które pomagają im wytwarzać własne cząsteczki niszczące RNA. Jedną z zalet tego rodzaju podejścia jest to, że wirusy pozwalają na stałe wytwarzanie cząsteczek niszczących RNA, teoretycznie umożliwiając jednorazowe leczenie. McBride bada swoją terapię, dostarczając ją małpom, które mają duże, złożone mózgi znacznie bardziej podobne do naszych. W szczególności jej zespół pracuje nad dostarczaniem wirusa do części mózgu zwanej „skorupą”. Skorupa jest szczególnie interesująca, ponieważ jest jednym z najbardziej wrażliwych regionów mózgu w HD – ulega znacznemu zanikowi u osób, które dziedziczą mutację HD. McBride opisuje udoskonalenia w operacji mózgu wymaganej do dostarczania wirusów, w tym wykorzystanie MRI do obrazowania mózgu podczas wstrzyknięć. Leczenie wirusowe doprowadziło do redukcji RNA genu HD o około połowę w całej skorupie, co stanowi znaczącą poprawę w porównaniu z poprzednimi próbami. Następnie – Mike Panzara z Wave Life Sciences, którzy planują 2 badania kliniczne wykorzystujące „Oligonukleotydy Antysensowne” (ASO) w HD. ASO to krótkie, zmodyfikowane fragmenty DNA, które wnikają do komórek i niszczą docelowe RNA, zmniejszając poziom docelowego białka.
Panzara informuje zgromadzonych, że Wave obecnie prowadzi dwie próby kliniczne ASO u pacjentów z HD. Dlaczego dwie? Podejście Wave polega na celowaniu w drobne warianty genetyczne – zwane SNP lub „snipami” – w genie HD. Te małe warianty nie powodują HD, są po prostu częścią normalnej zmienności genetycznej między ludźmi – powodem, dla którego nie jesteśmy wszyscy identycznymi bliźniakami. Co ciekawe, te warianty występują tylko na jednej z 2 kopii genu HD, które posiada każda osoba. Celując w te warianty, ASO firmy Wave mogą rozróżnić między zmutowaną a niezmutowaną kopią genu HD. Wave obecnie prowadzi wczesne badania bezpieczeństwa 2 ASO w badaniach nazwanych PRECISION-HD1 i PRECISION-HD2. ASO używane w tych badaniach celują w różne warianty genetyczne w genie HD. Sztuczka w tym podejściu polega na tym, że ludzie muszą nie tylko odziedziczyć mutację HD, ale także towarzyszące warianty, które pozwalają na unikalne celowanie w zmutowaną kopię genu. Więc te badania z konieczności skupiają się na pacjentach noszących te warianty. Wave opracowało naprawdę fajne nowe technologie do wykrywania tych wariantów i określania, które są na zmutowanej kopii genu HD, a nie na normalnej kopii. Wave przeprowadziło wstępne badanie, w którym udało im się znaleźć cele dla swoich ASO u 64% ochotników
„Spontaniczne oklaski, gdy Tabrizi dziękuje odważnym ochotnikom w pierwszym badaniu, nazywając ich „prawdziwymi bohaterami badań”.”
Następnie Anne Smith z Ionis i Sarah Tabrizi z UCL prezentują wyniki badania zaprojektowanego do testowania ASO celujących w obie kopie genu HD. To zwieńczenie wielu lat pracy – Smith przypomina publiczności, że program Ionis rozpoczął się w 2005 roku! Zaczęli od badań na komórkach i zwierzętach, które dostarczyły wczesnych dowodów na to, że leczenie ASO zmniejsza ilość białka huntingtyny i poprawia objawy podobne do HD. W 2012 i 2013 roku opublikowano wyniki badań na mysich modelach HD, które wykazały, że obniżenie huntingtyny poprawiło objawy podobne do HD. Smith przedstawia logikę, którą @ionispharma zastosowała przy podejmowaniu decyzji o użyciu ASO celujących w obie kopie genu HD, a nie tylko w zmutowaną kopię. Jedną z zalet ASO jest to, że rozprzestrzeniają się szeroko w mózgu. Smith pokazuje dane z eksperymentów na małpach, które demonstrują, że po wstrzyknięciu do płynu mózgowo-rdzeniowego, ASO rozprzestrzeniają się bardzo szeroko w mózgu. Ionis badał także dystrybucję u jeszcze większych zwierząt, takich jak świnie, stwierdzając, że lek rozprzestrzeniał się bardzo szeroko. Następnie przeprowadzono badania toksyczności, sugerujące, że długotrwałe podawanie leku było bardzo dobrze tolerowane (nawet do 15 miesięcy w badaniach na małpach). Prawie niemożliwe jest pobranie próbek tkanki mózgowej od pacjentów leczonych ASO – więc skąd będziemy wiedzieć, czy ASO wykonało swoje zadanie? Smith opisuje badania na małpach ustalające związek między obniżeniem huntingtyny w mózgu a obniżeniem w płynie mózgowo-rdzeniowym. To pozwoliło Ionis zbudować bardzo skomplikowany program komputerowy do przewidywania, jak duże obniżenie huntingtyny zachodzi w mózgu i płynie mózgowo-rdzeniowym, który jest łatwo dostępny przez punkcję lędźwiową. W tym momencie do Ionis dołączył duży partner farmaceutyczny, Roche, który ma zasoby i doświadczenie w prowadzeniu skomplikowanych badań klinicznych dla ASO.
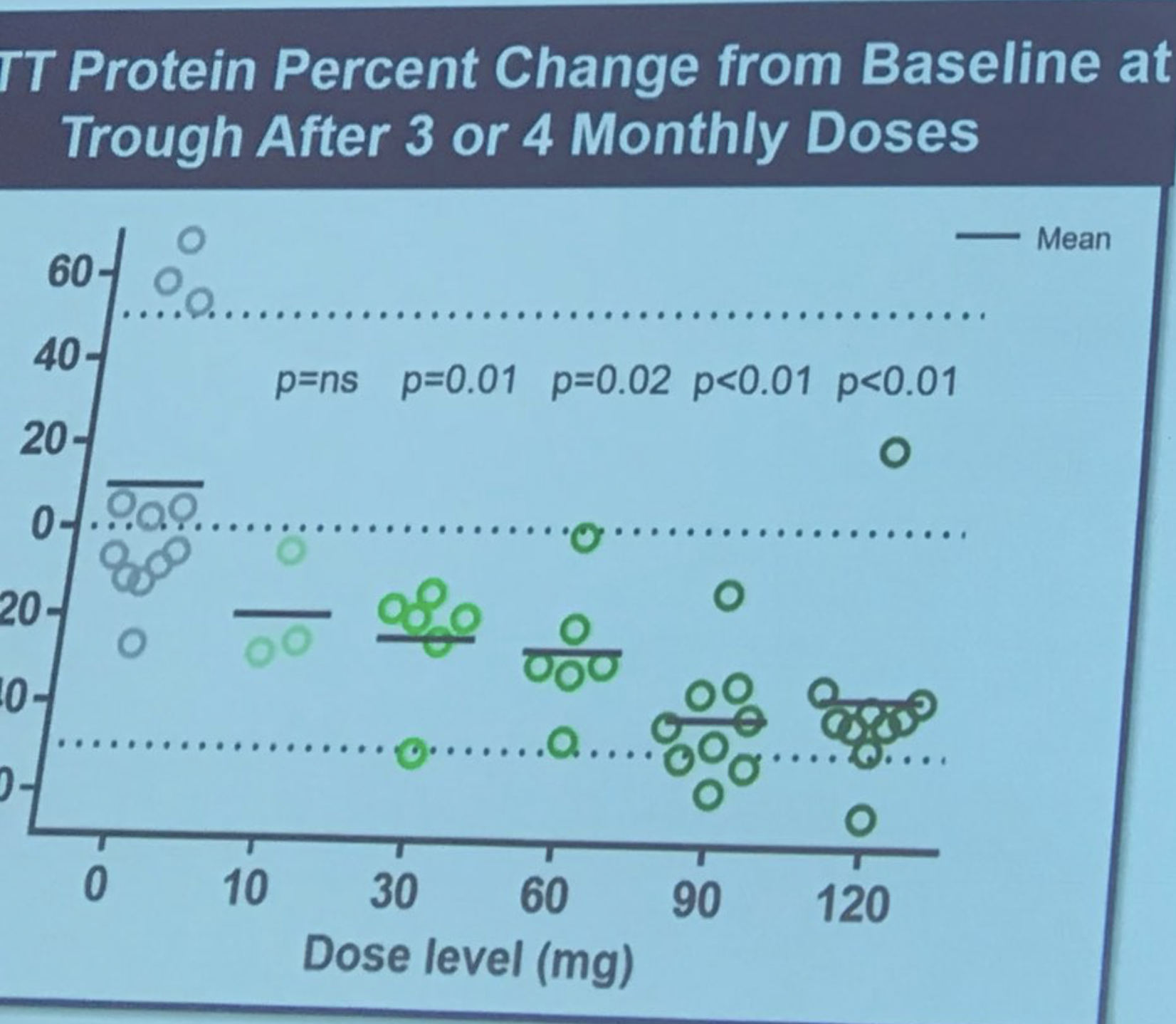
Sarah Tabrizi wychodzi na scenę, aby opisać pierwsze ludzkie badanie leczenia ASO Ionis/Roche. To badanie było badaniem „bezpieczeństwa” – głównym powodem przeprowadzenia badania było ustalenie, czy lek jest bezpieczny. Badanie przeprowadzono w 9 ośrodkach w Wielkiej Brytanii, Niemczech i Kanadzie. ASO podawano pacjentom przez infuzję do płynu mózgowo-rdzeniowego w „rosnącej dawce”, co oznacza, że wcześniejsi uczestnicy otrzymywali niską dawkę, a późniejsi wyższą. To ostrożne zwiększanie dawki jest robione, aby umożliwić oceny bezpieczeństwa przez lekarzy niezależnych od badania. W tym badaniu wzięło udział 46 niezwykle odważnych ochotników, którzy byli gotowi podjąć pewne ryzyko bycia pierwszymi osobami narażonymi na działanie leku. Badacze byli w stanie zmierzyć poziomy białka huntingtyny w płynie mózgowo-rdzeniowym – co wcześniej wykazało, że bardzo dobrze koreluje z poziomami w mózgu (których, pamiętajmy, nie możemy zmierzyć bezpośrednio).
Wielkość redukcji jest naprawdę uderzająca – średnio aż 40-50%! Tabrizi opisuje odczucia badaczy, że obniżenie huntingtyny może nadal się poprawiać nawet do 6 miesięcy. A oto jak bardzo Tabrizi przewiduje, że odpowiada to obniżeniu białka w mózgu. Ionis zbudował swego rodzaju model, który umożliwia im przewidywanie związku między obniżeniem huntingtyny w płynie mózgowo-rdzeniowym a w tkankach mózgu. To sugeruje, że obniżenie huntingtyny w tkance mózgowej może być dość wysokie. Pacjenci byli bardzo uważnie monitorowani pod kątem bezpieczeństwa, nie stwierdzono żadnych poważnych zdarzeń niepożądanych. Tabrizi – „Lek był bezpieczny i dobrze tolerowany we wszystkich testowanych dawkach”. Sukces! Wszyscy uczestnicy badania są teraz w tzw. „otwartym przedłużeniu badania” – ci, którzy byli na placebo, zostali przeniesieni na lek i będą nadal monitorowani. Spontaniczne oklaski, gdy Tabrizi dziękuje odważnym ochotnikom w pierwszym badaniu, nazywając ich „prawdziwymi bohaterami badań”.
Co za sposób na zakończenie spotkania – niezwykle ekscytujące czasy przed nami, gdy Roche i Ionis planują następne badanie, które będzie zaprojektowane, aby określić, czy lek poprawia objawy HD u większej liczby osób.
Aktualizacja: Oświadczenie dla społeczności Ionis na temat wyników.
Dowiedz się więcej
Więcej informacji o naszej polityce ujawniania informacji znajdziesz w naszym FAQ…


