Białko naprawy DNA modyfikuje stabilność długich odcinków CAG w genie choroby Huntingtona
Naprawa DNA jest kluczowym procesem dla komórek, ale błędy w tym procesie mogą wyjaśniać 'niestabilność powtórzeń’ w HD
Białko MSH3 pełni ważną funkcję w komórkach, wyszukując i pomagając naprawiać genetyczne błędy i uszkodzone DNA. Jednak nowe badanie naukowców z Uniwersytetu w Toronto i Szpitala dla Chorych Dzieci sugeruje, że MSH3 może przyczyniać się do postępu choroby Huntingtona poprzez zwiększanie niestabilności powtórzeń CAG w mózgu.
Problem niestabilności genetycznej
Podstawowa przyczyna choroby Huntingtona jest dobrze znana. Powtarzający się segment trzech elementów budulcowych kodu genetycznego Cytozyna-Adenozyna-Guanina (lub prościej, 'C-A-G’) blisko początku genu HD jest nadmiernie długi u osób, u których rozwija się choroba.

Powtórzenie CAG wykazuje dużą różnorodność w populacji, nawet u osób niechorych. Normalne długości powtórzeń mogą wahać się od 6 do 36, podczas gdy powtórzenia dłuższe niż 40 niezmiennie prowadzą do choroby Huntingtona.
Ale długość powtórzenia CAG ma też inne, predykcyjne właściwości. Nie tylko liczba powtórzeń może określić, czy dana osoba zachoruje na chorobę Huntingtona, ale może też w przybliżeniu przewidzieć wiek, w którym mogą zacząć pojawiać się objawy choroby. Im dłuższe powtórzenie, tym wcześniejszy początek HD, średnio rzecz biorąc.
W rodzinach, które noszą mutację, HD czasami wykazuje 'antycypację’ – techniczny sposób na powiedzenie, że początek choroby może nastąpić wcześniej z każdym kolejnym pokoleniem. Naukowcy odkryli, że tę antycypację można wyjaśnić zjawiskiem biologicznym zwanym 'niestabilnością genetyczną’.
Niestabilność odnosi się do tendencji powtarzających się odcinków DNA do wydłużania się w ciągu życia jednostki. Może to spowodować, na przykład, wydłużenie regionu C-A-G w genie HD.
Z powodów, które nie są zrozumiałe, niestabilność genetyczna występuje częściej w niektórych tkankach i typach komórek niż w innych. Na przykład, podczas gdy długości powtórzeń są dość stabilne we krwi (gdzie pobiera się próbki do testów genetycznych HD), często ulegają one ekspansji w komórkach nasienia.
Ta niestabilność genetyczna wyjaśnia, dlaczego w HD występuje antycypacja. Powtórzenia mają tendencję do wydłużania się, co średnio powoduje, że dzieci mają wcześniejszy początek choroby niż ich rodzice. Ponieważ ta ekspansja jest szczególnie powszechna w komórkach nasienia, ekspansje są bardziej prawdopodobne w genach HD odziedziczonych po ojcach niż po matkach.
Międzypokoleniowe efekty niestabilności genetycznej są znane od dość dawna. Jednak nowsze badania rzucają światło na to, jak może ona również wpływać na prognozę choroby u poszczególnych pacjentów.
Niestabilność w mózgu
Uszkodzenie mózgu w chorobie Huntingtona ma specyficzny wzorzec: nie wszystkie części mózgu degenerują w tym samym stopniu. Części mózgu, które są najbardziej podatne na obumieranie w HD, to prążkowie i kora mózgowa. Co ciekawe, naukowcy odkryli, że te regiony mózgu są również obszarami, które wykazują najbardziej znaczące poziomy niestabilności powtórzeń.
Ponieważ długość powtórzenia jest tak ściśle związana z wiekiem zachorowania na HD, wydłużanie się powtórzenia CAG w tych regionach mózgu mogłoby ewentualnie wyjaśnić, dlaczego są one selektywnie tracone w chorobie. Aby dodatkowo poprzeć tę ideę, pacjenci z HD, którzy wykazują najpoważniejsze uszkodzenia mózgu, to ci z najwyższymi poziomami niestabilności powtórzeń CAG.
Te odkrycia podnoszą ważne pytanie. Dlaczego niektórzy pacjenci z HD mają wyższe poziomy niestabilności genetycznej w mózgu? Który problem pojawia się pierwszy, czy większe uszkodzenie mózgu powoduje zwiększoną niestabilność, czy niestabilność powoduje gorsze uszkodzenie mózgu?
W próbie bezpośredniego rozwiązania tego problemu, zespół kierowany przez dr Christophera Pearsona ze Szpitala dla Chorych Dzieci w Toronto poszukiwał genów, które mogłyby kontrolować różnice w niestabilności genetycznej między poszczególnymi osobami. W tym poszukiwaniu jeden gen, zwany MSH3, wyłonił się jako główny kandydat.
„Niestety, jednym z produktów ubocznych procesu naprawczego jest to, że dodatkowe powtórzenia CAG mogą zostać błędnie wprowadzone do sekwencji. Niczym osuwisko, im więcej powtórzeń jest dodawanych, tym większy staje się pierwotny problem. To jest źródło niestabilności genetycznej.”
Dowody
Aby poszukać genów, które mogłyby kontrolować niestabilność genetyczną, badacze dodali mały, ale toksyczny fragment genu choroby Huntingtona do dwóch różnych szczepów myszy. Różne szczepy myszy są trochę jak ludzie z różnych rodzin lub różne rasy psów – chociaż wszystkie są myszami, mają odrębne tło genetyczne.
Badacze odkryli, że niestabilność genu choroby Huntingtona wystąpiła w jednym szczepie myszy (nazwanym B6), ale nie w drugim (nazwanym CBy). Na podstawie wcześniejszych badań nad niestabilnością genetyczną, przeprowadzonych przez laboratorium Pearsona i innych, badacze podejrzewali, że dramatyczna różnica między myszami może sprowadzać się do różnic w jednym konkretnym procesie biologicznym, zwanym naprawą niesparowanych zasad, a dokładniej jednym z jego głównych uczestników, białku MSH3.
Aby sprawdzić, czy genetyczne różnice w MSH3 powodowały zmianę w niestabilności powtórzeń, naukowcy przenieśli gen MSH3 z myszy CBy (które wcześniej nie wykazywały ekspansji powtórzeń CAG) do szczepu B6 i odwrotnie.
Wyniki były dramatyczne. Zamiana genów między szczepami myszy spowodowała całkowite odwrócenie niestabilności powtórzeń. Myszy CBy, które wcześniej były odporne na zwiększanie długości powtórzeń, teraz były szczepem o najwyższych poziomach, podczas gdy szczep B6 wykazywał niewielką niestabilność powtórzeń. Efekt podążał za genem MSH3!
Aby ustalić, co mogło powodować tę rozbieżność, badacze przyjrzeli się sekwencjom genetycznym genu MSH3 z obu szczepów myszy. W szczepie CBy zidentyfikowano pojedynczą mutację, która miała znaczący wpływ na funkcję MSH3. Ta pojedyncza mutacja powodowała, że białko MSH3 stawało się niestabilne i szybko degradowane przez komórkę. W rezultacie, każde MSH3 produkowane przez komórki było szybko rozkładane i poddawane recyklingowi, znacznie redukując jego ogólny poziom.
Te odkrycia sugerowały dwie rzeczy: po pierwsze, jeśli osoba naturalnie nosiłaby podobną mutację w swoim genie MSH3, mogłaby również mieć zmniejszoną niestabilność powtórzeń CAG, a tym samym lepszą prognozę choroby, a po drugie, że tworzenie leków celujących w MSH3 mogłoby być wartościowe w leczeniu choroby Huntingtona, zakładając, że niestabilność jest ważna.
Naprawa niesparowanych zasad i białko MSH3
Więc co dokładnie robi MSH3 i jak może wpływać na prognozę choroby Huntingtona? Aby najlepiej to wyjaśnić, musimy dowiedzieć się trochę o tym niezwykle ważnym procesie biologicznym wspomnianym wcześniej, naprawie niesparowanych zasad DNA.
Naprawa DNA, ogólnie rzecz biorąc, jest niezbędnym procesem, który pozwala naszym komórkom korygować błędy lub mutacje, które pojawiają się w naszym kodzie genetycznym. Te mutacje mogą być spowodowane wieloma zdarzeniami, niektórymi z normalnych aktywności komórkowych, a niektórymi z szkód środowiskowych, takich jak promieniowanie UV lub chemikalia. Niektóre uszkodzenia genetyczne mogą powodować pęknięcia w DNA, podczas gdy inne wprowadzają pojedyncze mutacje – zmiany w sekwencji liter w DNA.
Białka naprawy niesparowanych zasad, takie jak MSH2, MSH3 i MSH6, wyszukują dwa różne rodzaje błędów genetycznych: 'niedopasowania’, które występują, gdy DNA jest kopiowane w dzielących się komórkach, oraz małe pętle, które mogą tworzyć się w DNA po pojedynczym pęknięciu nici.
Powtórzenia CAG, które powodują HD, są szczególnie podatne na tworzenie tych małych pętli DNA. Powód jest związany z fundamentalnymi właściwościami DNA, które umożliwiają jego kopiowanie w komórce.
Źródło obrazu: Madeleine Price Ball
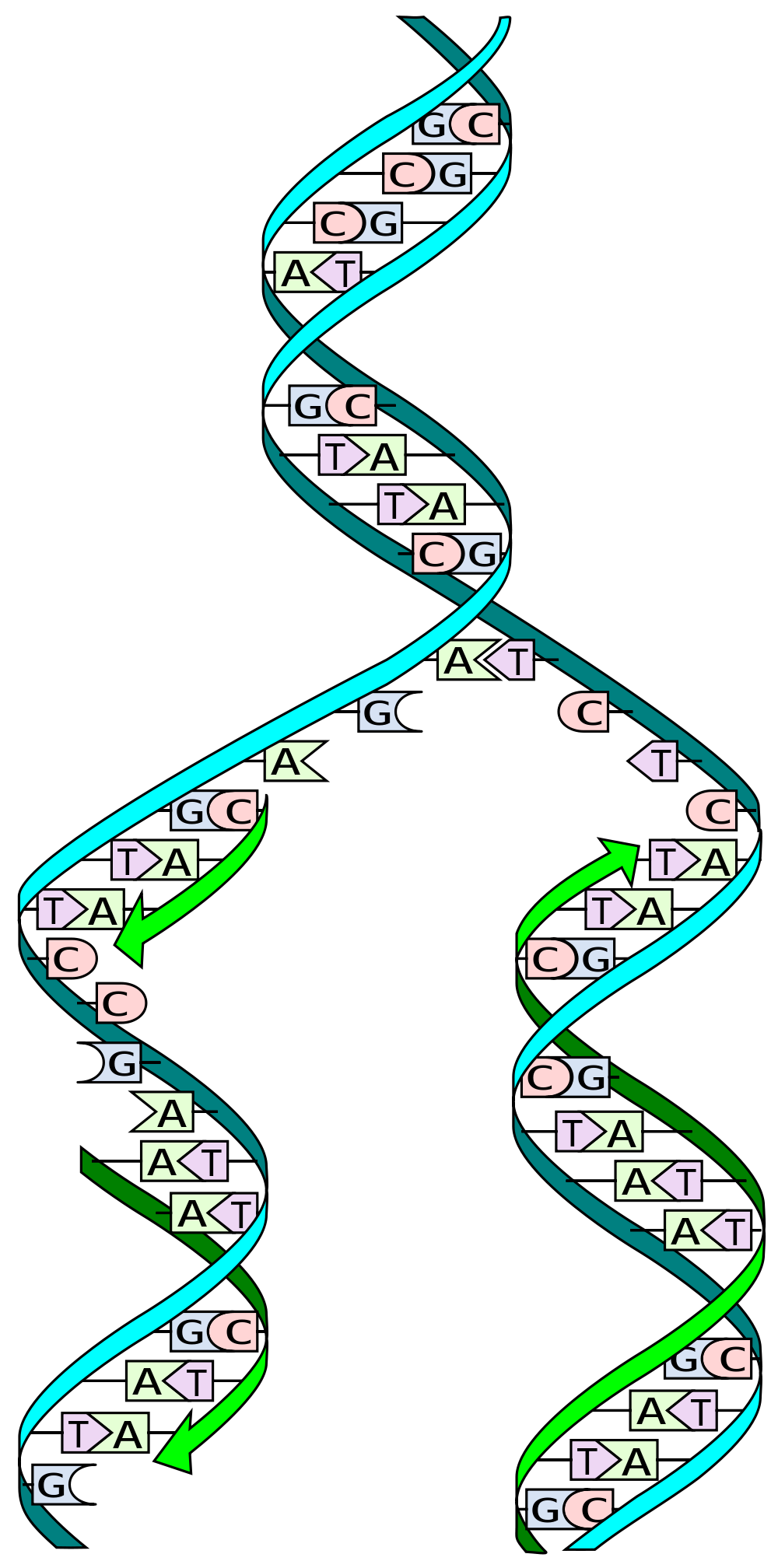
Wiele osób słyszało, że DNA jest 'podwójną helisą’. Oznacza to zasadniczo, że składa się z dwóch nici, które tworzą skręconą strukturę. Te nici DNA są często opisywane jako kopie siebie nawzajem lub lustrzane odbicie, ale jest to tylko częściowo prawdą.
DNA składa się tylko z 4 różnych genetycznych elementów budulcowych zwanych nukleotydami, które są nazwane cytozyną ©, guaniną (G), adenozyną (A) i tymidyną (T). C ma naturalne powinowactwo do G, podczas gdy A jest przyciągane do T.
Gdy DNA jest replikowane, podwójna helisa jest rozdzielana na dwie pojedyncze nici. Wyspecjalizowane maszyny molekularne, zwane 'polimerazami’, następnie odczytują kod genetyczny, literka po literce, generując nową drugą nić i, w rezultacie, nową kopię DNA.
Aby to zrobić, polimerazy wykorzystują naturalne powinowactwa nukleotydów. Na przykład, gdy maszyna napotyka C w sekwencji genetycznej, rekrutuje G do rosnącej nici DNA, a gdy wykrywa T, dopasowuje je z A. Dlatego mówimy, że dwie nici DNA nie są dokładną kopią siebie nawzajem. Dostarczają one informacji do stworzenia drugiej nici, ale nie są repliką.
Teraz wróćmy do powtórzeń CAG. Gdy jedna nić DNA pęknie w pobliżu lub wewnątrz długiego powtórzenia CAG, może to uwolnić tę nić do utworzenia pętli ze względu na naturalne powinowactwo C i G w jej sekwencji.
Dwa białka naprawy niesparowanych zasad, MSH2 i MSH3, łączą się, aby wyszukiwać i naprawiać tego typu pętle DNA. Niestety, jednym z produktów ubocznych procesu naprawy jest to, że dodatkowe powtórzenia CAG mogą być błędnie wprowadzane do sekwencji. Jak lawina, im więcej powtórzeń zostaje dodanych, tym większy staje się pierwotny problem. To jest źródło niestabilności genetycznej.
Co więc dokładnie dzieje się u myszy CBy, że są odporne na ekspansję powtórzeń? Przypomnijmy, że badacze odkryli, że myszy CBy miały mutację w sekwencji genetycznej MSH3, która powodowała niestabilność białka. Przy mniejszej dostępności MSH3 do znajdowania i korygowania pętli DNA w obrębie powtórzeń CAG genu HD – potencjalnie wprowadzając dodatkowe CAG w tym procesie – niestabilność genetyczna została zatrzymana.
Co dalej?
Co to wszystko oznacza dla pacjentów z chorobą Huntingtona? Na razie sugeruje to jedynie, że jednym z powodów, dla których występują różnice w wieku zachorowania między osobami z taką samą liczbą powtórzeń, może być różna zdolność ich białek MSH3 do naprawy tych pętli DNA. Jeśli byłyby osoby posiadające podobną mutację do tej zidentyfikowanej u myszy, mogłyby mieć opóźniony postęp choroby.
Teoretycznie, badanie sugeruje również, że gdybyśmy mogli zmodyfikować aktywność białka MSH3 u pacjentów z HD, moglibyśmy wpłynąć na stopień niestabilności powtórzeń w ich genie HD. Jeśli niestabilność powtórzeń jest istotna dla rozwoju HD, mogłoby to teoretycznie spowolnić rozwój choroby.
Wyzwaniem związanym z celowaniem w MSH3 jest jednak to, że naprawa DNA jest ważnym procesem dla wszystkich komórek w organizmie. Jeśli mutacje w genach nie mogą być skutecznie naprawiane, mogą się one kumulować i powodować raka. Pozostaje do ustalenia, czy zakłócenie aktywności MSH3 mogłoby być tolerowane na tyle, by zapobiec wystąpieniu HD, nie powodując przy tym innych poważnych chorób.
To badanie nie składa żadnych obietnic dotyczących potencjału terapeutycznego, ale z pewnością wzbudziło zainteresowanie śledzeniem MSH3 u pacjentów. Im więcej wiemy o różnych genach, które mogą wpływać na chorobę Huntingtona, tym lepiej można wykorzystać te informacje do zapewnienia lepszej opieki nad pacjentami poprzez dokładniejsze prognozy przebiegu choroby.
Dowiedz się więcej
Więcej informacji o naszej polityce ujawniania informacji znajdziesz w naszym FAQ…


