
Konferencja Terapeutyczna Choroby Huntingtona 2018 – dzień 3
Doniesienia z 3 dnia Konferencji Terapeutycznej Choroby Huntingtona: huntingtyna i obniżanie jej poziomu

Witamy z ostatniego dnia Konferencji Terapeutycznej HD 2018! Dzisiaj dwie sesje, pierwsza poświęcona białku wytwarzanemu z genu HD. Druga to doniesienia z badań nad obniżaniem poziomu huntingtyny prowadzonych przez Wave Life Sciences i Ionis Pharmaceuticals.
Czwartkowy poranek – huntingtyna
Każdy pacjent z HD odziedziczył tę samą mutację – wydłużenie sekwencji C-A-G. Ekspansja zachodzi w genie, który teraz nazywamy genem HD. Komórki używają genów jako instrukcji do wytwarzania białek – pierwsza dzisiejsza sesja koncentruje się na białku HD.

Sandrine Humbert (Universite Grenoble Alpes) od dawna interesuje się rozwojem mózgu oraz wpływem genu i białka HD na ten proces. Aby zrozumieć ten proces, laboratorium Humbert stworzyło mysz pozbawioną genu i białka HD w mózgu. Odkryli, że komórki pozbawione genu HD dzielą się i poruszają w nieprawidłowy sposób. Podczas rozwoju mózgu nowo narodzone komórki pełzają w kierunku swojej właściwej lokalizacji, często wspinając się po „linach” utworzonych przez inne komórki. Proces ten zmienia się po usunięciu genu HD, co sugeruje istotną rolę genu HD w tym procesie.
Andrea Caricasole (Park Naukowy IRBM) prowadzi szeroko zakrojone badania nad „modyfikacjami potranslacyjnymi” huntingtyny. Chodzi o niewielkie, chemiczne „dekoracje” huntingtyny. Te dekoracje umożliwiają komórkom modyfikację funkcji białek. Na przykład, białko huntingtyna ma prawdopodobnie dziesiątki tych znaczników, są dodawane i usuwane, poprawiając funkcje huntingtyny w odpowiedzi na szeroki zakres sygnałów. Wiele z dekoracji robi intrygujące rzeczy z huntingtyną, a nawet powstrzymuje zmutowane białko przed szkodzeniem komórkom. Pisaliśmy o tym wcześniej na HDBuzz. Zespół Caricasole opracowuje bardzo czułe testy do wykrywania indywidualnych dekoracji huntingtyny. Umożliwiają one śledzenie, które z dekoracji ulegają zmianie w trakcie choroby, i być może poszukiwanie sposobów ich naprawy.
Rohit Pappu (Washington University) prezentuje nieco inną drogę do wykrycia znaczenia huntingtyny. Jego laboratorium opracowuje narzędzia do badania tej części białka, której kształt zmienia się pod wpływem mutacji HD. Aby przewidzieć kształt części huntingtyny zmodyfikowanej przez mutację laboratorium Pappu wykorzystuje komputery o dużej mocy obliczeniowej. Dzięki tej technice zaobserwowano kształt „kijanki”. Kształt kijanki był przedmiotem intensywnej debaty na polu HD! Techniki Pappu wspierają jedną ze stron tej debaty, która z pewnością pomoże nam lepiej zrozumieć tę kluczową część białka huntingtyny
Xaio-Joang Li (Emory University) opracował interesujący mysi model, w którym u dorosłych myszy gen huntingtyny można wyłączyć w mózgu, ciele lub obu miejscach jednocześnie. Te myszy nie mają rozszerzonych genów huntingtyny – po prostu pomagają zrozumieć, czy wyłączenie ‘zdrowej’ wersji genu ma jakieś konsekwencje. Gdy gen jest wyłączony, w mózgu nie dzieje się nic złego, to pocieszające. Nieoczekiwanie, wyłączenie genu w ciele spowodowało zapalenie trzustki. Nie jest jasne, co to może oznaczać dla pacjentów, ale obecne leczenie obniżające ilość huntingtyny nie powinno znacząco zmniejszyć poziomu huntingtyny w ciele tylko w mózgu. Li wyciął także szkodliwą część genu HD u myszy (z pomocą edycji genomu CRISPR-Cas9). Dezaktywacja zmutowanego genu u myszy skutecznie zmniejszyła tworzenie toksycznej huntingtyny, myszy lepiej się również poruszały. Dr Li był bardzo zajęty! Stworzył również świński model choroby Huntingtona przy użyciu edycji genomu CRISPR. Może być przydatny do testowania nowych leków, ponieważ mózg świni jest podobny do mózgu człowieka.
„Kochanek zamroził białko i korzystając z wiązki elektronów wykonał tysiące zdjęć. Zdjęcia zostały następnie połączone komputerowo celem uzyskania pierwszych obrazów szczegółowej struktury molekularnej białka huntingtyny. ”
Ankur Jain (@UCSanDiego) bada RNA – „cząsteczki wiadomości” generowane, gdy komórka chce użyć instrukcji z DNA do wytworzenia białka. Nasze DNA żyje w jądrze naszych komórek, ale RNA pływa swobodnie po całej komórce. Tradycyjny sposób myślenia o wielu genetycznych chorobach mózgu zakłada, że są one powodowane przez toksyczne białka, tymczasem istnieje coraz więcej dowodów, że cząsteczki wiadomości RNA wytwarzane ze zmutowanych genów również mogą być czasem toksyczne. Na przykład, niektóre sekwencje RNA mogą przyczepiać się do ważnych maszyn białkowych i uniemożliwiać im wykonywanie działań w komórce. Jedną z możliwych oznak toksyczności RNA jest powstawanie nieprawidłowych skupień – kropelek RNA obserwowanych w komórkach w HD i innych chorobach mózgu. Jain odkrył, że może formować sztuczne krople RNA, ogrzewając je i chłodząc (jak galaretkę). Krople tworzą się tylko wtedy, gdy RNA zawiera lepkie sekwencje, takie jak ta z odcinka CAG w HD. Nie jest jasne, czy te krople RNA powodują szkody w HD, ale mogą. Na przykład, jeśli RNA utknie w jądrze, nie można go wykorzystać do generowania białek. Cząsteczki antysensowne (podobne do tych obecnie stosowanych w badaniach na ludziach z HD) mogą przylgnąć do RNA w jądrze i zapobiec tworzeniu się kropli. Inne leki teoretycznie mogłyby zostać wykorzystane do rozwiązania problemu lepkości RNA również w chorobach mózgu.
Ekscytująca, przełomowa rozmowa ze Stefanem Kochankiem, którego laboratorium właśnie odkryło strukturę huntingtyny! Sprawdzanie, jak wyglądają białka, jest naprawdę ważnym krokiem w zrozumieniu tego, jak działają i jak można to zmienić za pomocą leków. Gen huntingtyny został odkryty 25 lat temu, ale białko jest duże, chwiejne i lepkie, co znacząco utrudniło odkrycie jego struktury. Pewien zespół wysłał nawet białko w kosmos, w nadziei na uzyskanie kryształów, ale niestety, bez powodzenia. Zespół Kochanka odniósł sukces tam, gdzie inni polegli, a uzyskane wyniki właśnie zostały opublikowane w Nature. Wielkim przełomem było ustabilizowanie huntingtyny za pomocą innego białka zwanego HAP40 („białko związane z huntingtyną 40”). Po zabezpieczeniu za pomocą HAP40, Kochanek zamroził białko i korzystając z wiązki elektronów wykonał tysiące zdjęć. Zdjęcia zostały następnie połączone komputerowo celem uzyskania pierwszych obrazów szczegółowej struktury molekularnej białka huntingtyny. To naprawdę fajne i pozwala zrobić mnóstwo rzeczy. Jedno zastrzeżenie: niektóre obszary nadal były zbyt chwiejne by określić ich strukturę – dotyczy to również najważniejszego fragmentu na początku białka, które zawiera mutację.
Czwartkowe popołudnie – redukowanie huntingtyny
Wielki koniec dnia i konferencji, rozpoczyna się sesja na temat terapii redukowania huntingtyny. Obniżenie poziomu huntingtyny odnosi się do metod leczenia mających na celu obniżenie ilości huntingtyny w komórkach nerwowych. Istnieje wiele sposobów, aby to zrobić, w wielu celem jest „RNA”, który jest pośrednikiem pomiędzy informacjami w genie HD a huntingtyną.
Michael Rape (UC Berkeley) interesuje się nakłanianiem komórek do niszczenia pojedynczych białek w komórce. W wielu przypadkach (również w HD) naprawdę pomocne byłoby selektywne usunięcie jednego określonego białka. Komórki mają kilka sposobów degradacji białek – jeden z ważnych jest związany z małą substancją chemiczną zwaną „ubikwityną”, wykorzystywaną jako etykieta. Komórki rozpoznają ubikwitynę jako swego rodzaju sygnał „zjedz mnie” i niszczą białka nią oznaczone. Laboratorium Rape’a zaangażowało się w ustalenie, jak komórki wykorzystują znaczniki ubikwitynowe do znakowania białek, które powinny zostać zniszczone bardzo szybko – na przykład toksycznych. Laboratorium Rape’a zbudowało narzędzia, które pozwalają badaczom po raz pierwszy obserwować białka przechodzące przez ścieżkę szybkiej degradacji. Mechanizm szybkiego niszczenia białek jest potężnym narzędziem – jedno z laboratoriów Rape’a jest zainteresowane jego wykorzystaniem. Niedawno opracowana technika – zwana „PROTAC” – umożliwia naukowcom wykorzystanie systemu ubikwityny do nakłaniania komórek do niszczenia określonych białek.
Scott Zeitlin (University of Virginia) pracuje z myszami HD, chcąc dowiedzieć się, co się dzieje, gdy zredukowana zostanie ilość zmutowanej huntingtyny, normalnej huntingtyny lub obu. Pamiętaj, że każda osoba dziedziczy po jednej kopii genu huntingtyny od każdego rodzica – a większość osób z HD ma jedną normalną i jedną zmutowaną kopię. Naukowcy nazywają zdrowe białko „naturalnym”, ponieważ jest ono bardziej powszechne w środowisku naturalnym. Te kwestie są ważne, ponieważ wszystkie terapie obniżające ilość huntingtyny mają na celu zmniejszenie całkowitej ilości huntingtyny w mózgu. Niektóre, podobnie jak lek Ionis, redukują obie wersje białka w równym stopniu. Inne, jak lek Wave, dążą do większego zredukowania mutacji niż białka naturalnego. Możliwe, że redukcja wyłącznie zmutowanego białka lub równoczesna redukcja obu typów białka będzie korzystna – ale pytanie, czy redukowanie ilości huntingtyny jest bezpieczne wciąż pozostaje otwarte. Zeitlin wyhodował myszy, u których produkcja zmutowanej, naturalnej lub obu typów białka może zostać zredukowana po osiągnięciu stadium dojrzałego osobnika. Zeitlin stwierdził, że wcześniejsze obniżenie zmutowanej huntingtyny miało większy wpływ na gromadzenie się białka w mózgu. Podobnie wczesna redukcja zmutowanej huntingtyny ograniczyła utratę wagi i wpłynęła pozytywnie na umiejętności poruszania się myszy. To samo dotyczy zmniejszenia produkcji obu wersji białka – wcześniejsze leczenie przynosiło większe korzyści. Podkreślenie: wcześniej znaczy lepiej, jeśli chodzi o poskramianie huntingtyny. W przypadku jednego testu (testu siły chwytu) redukcja wyłącznie zmutowanego białka poprawiła wydajność, natomiast obniżenie obu wersji – nie. W pozostałych przypadkach obydwa podejścia były mniej więcej tak samo skuteczne, a kluczowym/decydującym czynnikiem było to, jak wcześnie leczenie zostało podjęte. Zeitlin przyjrzał się również temu, co się stanie jeśli poziom huntingtyny wróci do poziomu sprzed leczenia. Okazało się, że dla myszy taka sytuacja była niekorzystna. To sugeruje, że długotrwałe leczenie jest lepsze niż krótkoterminowe – można się było tego spodziewać.
Jodi McBride (OHSU) opisuje prace z użyciem nieszkodliwych wirusów. Mają one dostarczyć komórkom mózgowym instrukcje, dzięki którym będą mogły one tworzyć własne cząsteczki niszczące RNA. Jedną z korzyści tego rodzaju podejścia jest to, że dzięki wirusom cząsteczki niszczące RNA będą tworzone w nieskończoność, w teorii umożliwiając jednorazowe leczenie. McBride testuje swoją kurację na małpach, których mózgi są duże, skomplikowane i znacznie bardziej podobne do naszych. Zespół pracuje w szczególności nad dostarczeniem wirusa do części mózgu zwanej „skorupą”. Skorupa jest interesująca, ponieważ jest jednym z najbardziej uszkadzanych regionów mózgu – znacznie się kurczy u osób, które odziedziczyły mutację HD. McBride przedstawia ulepszenia w zakresie zabiegów chirurgicznych dostarczających wirusy bezpośrednio do tkanki nerwowej, w tym wykorzystanie MRI do obrazowania mózgu w miarę podawania kolejnych zastrzyków. Leczenie wirusowe doprowadziło do redukcji RNA genu HD o około połowę w całej skorupie, co stanowi znaczną poprawę w stosunku do wcześniejszych prób.
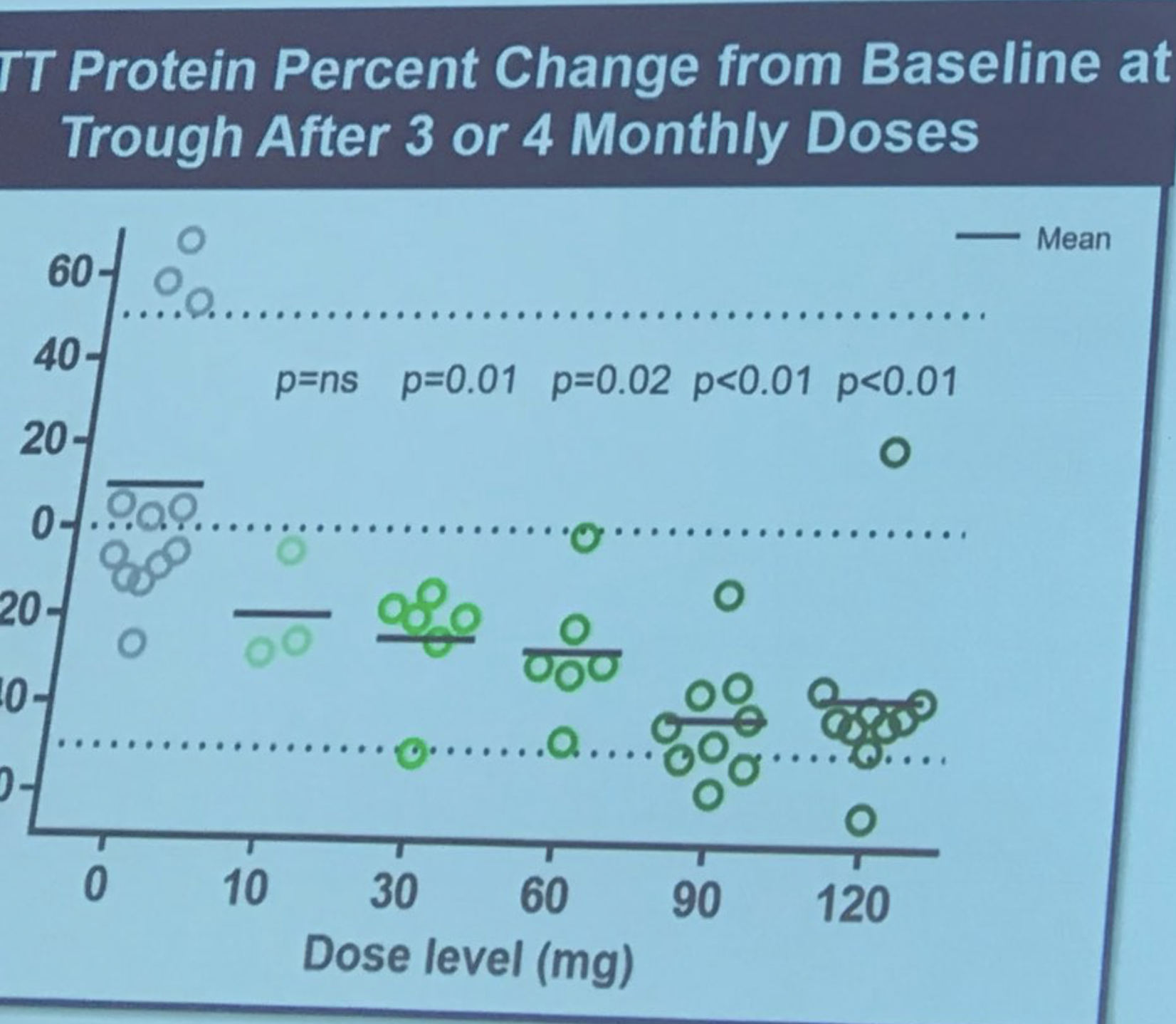
Następny jest Mike Panzara z Wave Life Sciences, które planuje 2 próby z użyciem „antysensownych oligonukleotydów” (ASO) w HD. ASO to krótkie, zmodyfikowane fragmenty DNA, które wchodzą do komórek i niszczą docelowy RNA, redukując poziom wybranego białka. Panzara mówi, że Wave prowadzi obecnie dwie próby ASO u pacjentów HD. Dlaczego dwie? Podejście Wave polega na celowaniu w niewielkie odmienności w genie HD, nazywane SNP lub „snip”. Te drobne wariacje nie powodują HD, są tylko częścią normalnej genetycznej różnorodności ludzi – to dzięki nim nie jesteśmy identycznymi. Co ciekawe, te wariacje występują tylko w jednej z 2 kopii genu HD, które posiada każdy człowiek. Poprzez ukierunkowanie na te warianty, ASO Wave mogą rozróżnić zmutowaną i niezmutowaną kopię genu HD. Wave prowadzi obecnie badania bezpieczeństwa dwóch ASO w badaniach zwanych PRECISION-HD1 i PRECISION-HD2. ASO stosowane w tych badaniach celują w różne warianty genetyczne genu HD. Sztuczka polega na tym, że pacjenci nie tylko musieli odziedziczyć mutację HD, ale także odmienności genu umożliwiające unikatową lokalizację zmutowanej kopii. Zatem te badania są skoncentrowane wyłącznie na pacjentach posiadających te warianty. Wave opracowała naprawdę fajne, nowe technologie do wykrywania odmienności i określania, czy znajdują się w zmutowanej kopii genu HD. Wave przeprowadziła wstępne badanie, w którym znaleziono cele dla ASO u 64% ochotników.
„Spontaniczne brawa, tak Tabrizi dziękuje odważnym wolontariuszom z pierwszego badania, nazywając ich „prawdziwymi bohaterami badań”.”
Następnie Anne Smith (Ionis) i Sarah Tabrizi (UCL) przedstawiają wyniki badania zaprojektowanego do sprawdzenia ASO ukierunkowanych na obie kopie genu HD. To kulminacja wielu lat pracy – Smith przypomina publiczności, że program Ionis rozpoczął się w 2005 roku! Zaczynano od badań nad komórkami i zwierzętami, które dostarczyły dowodów na to, że leczenie ASO zmniejsza ilość huntingtyny i redukuje objawy typowe dla HD. W latach 2012 i 2013 opublikowano wyniki badań z modelu HD na myszach, które wykazały obniżenie ilości huntingtyny i redukcję objawów HD. Smith wyjaśnia dlaczego @ionispharma zdecydowała się na użycie ASO skierowanych przeciwko obu kopiom genu HD, a nie tylko kopii zmutowanej. Jedną z korzyści ASO jest to, że szeroko rozprzestrzeniają się w mózgu. Smith pokazuje dane z eksperymentów na małpach dowodzące, że po wstrzyknięciu w rdzeń kręgowy ASO rozprzestrzeniają się w mózgu bardzo szeroko. Ionis badał dystrybucję leku także na większych zwierzętach (takich jak świnie) z bardzo podobny skutkiem. Następnie przeprowadzono badania toksyczności, które wykazały, że długotrwałe podawanie leku było bardzo dobrze tolerowane (aż 15 miesięcy w badaniach na małpach). Pobranie próbki tkanki mózgowej od pacjentów leczonych ASO jest niemal niemożliwe – skąd zatem będziemy wiedzieć, czy ASO wykonał swoją pracę? Smith opisuje badania na małpach, które ustanawiają związek między obniżaniem poziomu huntingtyny w mózgu i redukcją w płynie rdzeniowym. Pozwoliły ona na zbudowanie bardzo skomplikowanego programu komputerowego do przewidywania skuteczności redukcji huntingtyny w mózgu i płynie rdzeniowym, który jest łatwo dostępny przez nakłucie lędźwiowe. Na tym etapie do Ionis dołączył duży partner farmaceutyczny, Roche, który ma zasoby i doświadczenie, aby przeprowadzić skomplikowane testy ASO wśród ludzi.
Sarah Tabrizi opisuje pierwsze badanie leczenia ASO Ionis/Roche wśród pacjentów. Było to badanie „bezpieczeństwa” – głównym powodem przeprowadzenia badania było ustalenie, czy lek będzie bezpieczny. Badanie przeprowadzono w 9 ośrodkach w Wielkiej Brytanii, Niemczech i Kanadzie. ASO podawano pacjentom do płynu mózgowo-rdzeniowego w formule „rosnącej dawki”, co oznacza, że pierwsi badani pacjenci otrzymywali niską dawkę, a kolejni coraz wyższe dawki ASO. Ostrożne dawkowanie miało umożliwić przeprowadzenie oceny bezpieczeństwa przez niezależnych od badania lekarzy. W badaniu wzięło udział 46 niesamowicie odważnych wolontariuszy gotowych przyjmować nowy lek. Naukowcy mogli zmierzyć ilość huntingtyny w płynie mózgowo-rdzeniowym – która, jak wcześniej wykazali, jest bardzo dobrze skorelowana z ilością białka w mózgu (pamiętajmy, ilości huntingtyny w mózgu nie możemy bezpośrednio zmierzyć).
Skala obniżenia jest naprawdę uderzająca – średnio aż 40-50%! Tabrizi przedstawia przypuszczenia badaczy, że obniżony poziom huntingtyny może utrzymywać się nawet przez 6 miesięcy. Ionis zbudował model, który umożliwia im przewidywanie relacji między redukcją ilości huntingtyny w płynie mózgowo-rdzeniowym i w mózgu. Model sugeruje, że obniżenie ilości huntingtyny w tkance nerwowej może być dość wysokie. Pacjentów monitorowano bardzo ostrożnie ze względu na bezpieczeństwo, nie wykryto żadnych poważnych zdarzeń niepożądanych. Tabrizi – „Lek był bezpieczny i dobrze tolerowany we wszystkich testowanych dawkach”. Sukces! Wszyscy badani przeszli teraz do tak zwanego badania otwartego (open label) – osoby dotąd przyjmujące placebo teraz przyjmują lek i będą nadal monitorowane. Spontaniczne brawa, tak Tabrizi dziękuje odważnym wolontariuszom z pierwszego badania, nazywając ich „prawdziwymi bohaterami badań”.
Cóż za sposób na zakończenie spotkania – niesamowicie ekscytujące czasy, Roche i Ionis planują kolejną próbę mającą ustalić, czy lek wpływa na objawy HD u większej liczby osób.
Aktualizacja: oświadczenie społeczności Ionis o wynikach.
Dowiedz się więcej
For more information about our disclosure policy see our FAQ…


